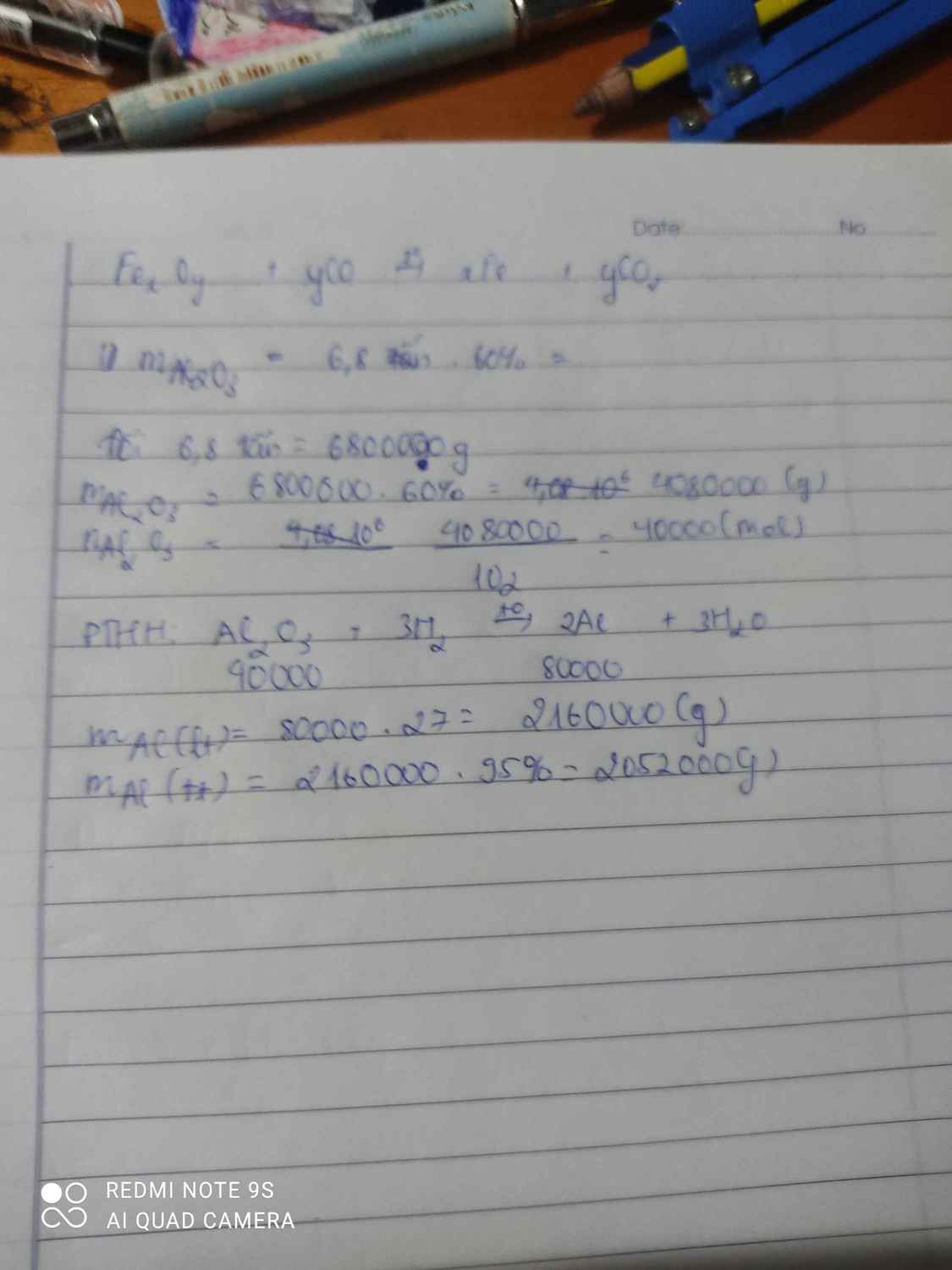có 5 tấn quặng bô xít chứa 55%kim loại nhôm.Người ta tinh luyện lấy nhôm cần qua nhiều bước .Bước 1 loại bớt khối lượng tạp chất trong quặng nhưng cũng có tới 0,2% lượng nhôm trong tạp chất ra ngoài .Bước 2 người ta loại tiếp các tạp chất để dược sản phẩm nhôm chiếm 98% .Hỏi sau bước 2 sản phẩm thu được bao nhiêu kg?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nửa tấn=500000g
2Al2O3-->4Al+3O2
Khối lượng Al2O3 nguyên chất trong nửa tấn quặng bô-xít là
500000.50%=250000(g)
Số mol của Al2O3 là
n=m/M=250000/102
=125000/51(mol)
Số mol của Al là
nAl=2nAl2O3=2.125000/51
=250000/51(mol)
Khối lượng của Al là
m=n.M=250000/51.27
=2250000/17( g)
Khối lượng của Al nguyên chất là
2250000/17-
(2250000/17.1.5%)
=2216250/17(g)

Lượng nhôm oxit có trong 0,5 tấn quặng là : 0,5x50/100 = 0,25 tấn = 250kg
Phương trình hoá học điều chế Al :
2 Al 2 O 3 → 4Al + 3 O 2
Khối lượng Al nguyên chất thu được từ 250 kg quặng :
x = 250x4x27/(2x102) = 132,4(kg)
Khối lượng Al lẫn tạp chất: 132,4 x 101,5% = 134,386 (kg).

chứa % tạp chất vậy đó là bao nhiêu phần trăm em ơi?

a)
$m_{Fe_2O_3} = 1000.90\% = 900(kg)$
$n_{Fe_2O_3} = \dfrac{900}{160} = 5,625(kmol)$
$n_{Fe} = 2n_{Fe_2O_3} = 11,25(kmol)$
$m_{Fe} = 11,25.56 = 630(kg)$
b)
$n_{Fe} = \dfrac{1000}{56}(kmol)$
$n_{Fe_2O_3} = 0,5n_{Fe} = \dfrac{125}{14}(kmol)$
$m_{Fe_2O_3} = \dfrac{125}{14}.160 = \dfrac{10000}{7}(kg)$
$m_{quặng} = \dfrac{10000}{7} : 90\% = 1587,3(kg)$

Phản ứng xảy ra:
\(2Al_2O_3\underrightarrow{^{đpnc}}4Al+3O_2\)
\(m_{Al2O3}=1000.50\%=500\left(kg\right)\)
\(\Rightarrow n_{Al2O3}=\frac{500}{102}\left(mol\right)\Rightarrow n_{Al}=2n_{Al2O3}=\frac{500}{51}\left(mol\right)\)
\(\Rightarrow m_{Al}=\frac{500}{51}.27=264,7\left(kg\right)\)
\(\Rightarrow m_{\left(nhom.thu.duoc\right)}=\frac{264,7}{97,5\%}=271,5\left(kg\right)\)

a) 2Al2O3 --------> 4 Al + 3O2
b) Theo ĐLBTKL, ta có khối lượng của Al2O3 bị phân hủy là:
mAl2O3 = mAl+ mO2
= 5,4+ 4,8= 10,2 (g)
c) % tạp chất trong quặng trên là:
100- ( \(\frac{10,2}{20,4}\). 100)= 50%

Theo đlbtkl:
mAl2O3=mAl+mO2
->mAl2O3=5.4+4.8=10.2(kg)
mtạp chất=20.4-10.2=10.2(g)
->% tạp chất không bị phân hủy=50%
a)PTHH:2Al2O3---->4Al+3O2
b)mAl2O3=Al+O2
=5.4+4.8
=10.2(g)
c)mtạp chất=20,4-10,2
=10,2(g)
%tạp chất=(10,2:20,4)*100%=50%