Đốt cháy hoàn toàn 0,1 mol một axit cacboxylic đơn chức cần vừa đủ V lít O2 (đktc), cho toàn bộ sản phẩm vào bình chứa nước vôi trong dư, thu được 30 gam kết tủa và khối lượng bình nước vôi tăng 16,8 gam. Tính V.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


mCO2+mH20=16.8
nCO2=nCaCO3=0.3 mH20=3.6
nH20=0.2 nên nO2 cần dùng=0.3+0.1-0.1=0.3
V=0.3*22.4=6.72
Đáp án C

♦ Bài tập đốt cháy hợp chất hữu cơ thuần ||→ quan tâm đến CTPT của các chất.
X gồm C3H4O2 + C18H34O2 + C4H6O2 + C5H8O2. Điểm chung: đều có 2π (πCO và πC=C).
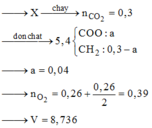
||→ đốt 5,4 gam X + O2 → 0,3 mol CO2 + (0,3 – x) mol H2O
||→ tương quan ∑nCO2 – ∑nH2O = nX ||→ nX = x mol.
||→ mX = mC + mH + mO = 0,3 × 12 + 2 × (0,3 – x) + 32x = 5,4 gam ||→ x = 0,04 mol.
||→ nO2 cần đốt = 0,39 mol → V = 8,736 lít. Chọn đáp án A. ♥.
♦ Cách 2:
||→ quy 5,4 gam X về 0,3 mol CH2 + (5,4 – 0,3 × 14) ÷ (32 – 2) = 0,04 mol O2H–2
||→ nO2 cần đốt = 0,3 × 1,5 – (0,04 + 0,04 ÷ 2) = 0,39 mol → kết quả tương tự

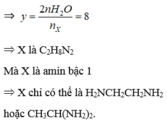
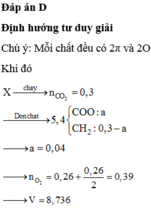

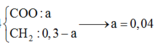
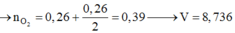
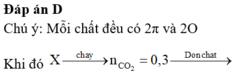
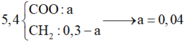
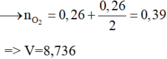
\(CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\\ n_{CO_2} = n_{CaCO_3} = \dfrac{30}{100} = 0,3(mol)\\ m_{H_2O} + m_{CO_2} = m_{tăng} \Rightarrow n_{H_2O} = \dfrac{16,8-0,3.44}{18} = 0,2(mol)\\ \)
Bảo toàn nguyên tố với O :
\(2n_{axit} + 2n_{O_2} = 2n_{CO_2} + n_{H_2O} \\ \Rightarrow n_{O_2} = \dfrac{0,3.2 + 0,2-0,1.2}{2} = 0,3(mol)\\ \Rightarrow V = 0,3.22,4 = 6,72(lít)\)