Cho 44,8 lít hỗn hợp X gồm O2 và O3 (đkc) qua bình đựng Ag dư ở nhiệt độ thường, sau
phản ứng khối lượng chất rắn tăng 1,28g. Tính % theo thể tích của O3 trong X.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A.
n X = 0 , 05 ( m o l ) n I 2 = 0 , 025 ( m o l ) O 3 + 2 K I + H 2 O → 2 K O H + O 2 + I 2 0 , 025 ← 0 , 025 ( m o l ) % V O 3 = 0 , 025 0 , 05 . 100 % = 50 %

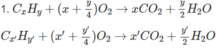
H 2 S O 4 + n H 2 O → H 2 S O 4 .n H 2 O
2NaOH + C O 2 → N a 2 C O 3 + H 2 O
Số mol
C
O
2
là: 
Khối lượng C trong hỗn hợp A là: 0,095.12 = 1,14 (g).
Khối lượng H trong hỗn hợp A là: 1,3 - 1,14 = 0,16 (g).
Số mol
H
2
O
sau phản ứng là: 
Để tạo ra 0,095 mol C O 2 cần 0,095 mol O 2 ;
Để tạo ra 0,08 mol H 2 O cần 0,04 (mol) O 2 .
Số mol O 2 đã tham gia phản ứng là: 0,095 + 0,04 = 0,135 (mol).
Số mol
O
2
ban đầu là: 
Số mol O 2 còn dư là: 0,155 - 0,135 = 0,02 (mol).
Số mol 3 chất trong bình sau phản ứng:
0,095 + 0,08 + 0,02 = 0,195 (mol).
Nếu ở đktc thì V O = 0,195.22,4 = 4,37 (lít).
Thực tế V2 = 8,4 lít
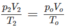
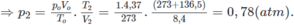
2. Đổi thể tích hỗn hợp khí trước phản ứng về đktc:
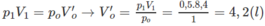
Số mol khí trước phản ứng: 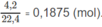
Số mol 2 hiđrocacbon: 0,1875 - 0,155 = 0,0325 (mol).
Đặt lượng C n H 2 n là a mol, lượng C m H 2 m - 2 là b mol, ta có a + b = 0,0325.
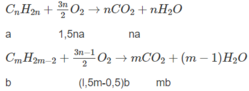
Số mol O 2 : l,5na + (l,5m - 0,5)b = 0,135 (2)
Số mol C O 2 : na + mb = 0,095 (3)
Từ (2) và (3), tìm được b = 0,015 ⇒ a = 0,0175
Thay các giá trị của a và b vào (3), ta có :
1,75. 10 - 2 n + 1,5. 10 - 2 m = 9,5. 10 - 2
7n + 6m = 38
Nếu n = 2 thì 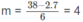
Nếu n = 3 thì 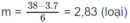
Nếu n > 3 thì m < 2 (loại).
% về thể tích của
C
2
H
4
: 
% về thể tích của C 4 H 6 là 46,2%

a.\(m_{Br_2}=m_{C_2H_4}=11,2g\)
\(n_{hh}=\dfrac{13,44}{22,4}=0,6mol\)
\(n_{C_2H_4}=\dfrac{11,2}{28}=0,4mol\)
\(\%V_{C_2H_4}=\dfrac{0,4}{0,6}.100=66,66\%\)
\(\%V_{CH_4}=100\%-66,66\%=33,34\%\)
\(m_{CH_4}=\left(0,6-0,4\right).16=3,2g\)
\(\%m_{C_2H_4}=\dfrac{11,2}{11,2+3,2}.100=77,77\%\)
\(\%m_{CH_4}=100\%-77,77\%=22,23\%\)
b.
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,2 0,4 ( mol )
\(C_2H_4+5O_2\rightarrow\left(t^o\right)2CO_2+2H_2O\)
0,4 2 ( mol )
\(V_{kk}=\left(2+0,4\right).22,4.5=53,76.5=268,8l\)

1. Đổi thể tích hỗn hợp khí trong bình trước phản ứng về đktc:
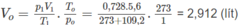
Số mol các chất trong bình trước phản ứng là:
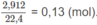
Số mol O2 = 0,1 (mol) ⇒ Số mol 2 ancol = 0,13 - 0,1 = 0,03 (mol).
Khi 2 ancol cháy :
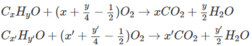
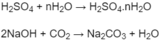
Số mol
H
2
O
là: 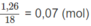
Số mol
C
O
2
là: 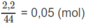
Theo định luật bảo toàn khối lượng :

= 3,2 + 0,03.16 - 0,07.16 - 0,05.32 = 0,96 (g).
Số mol
O
2
còn dư: 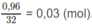
Tổng số mol các chất trong bình sau phản ứng :
0,07 + 0,05 + 0,03 = 0,15 (mol).
Thể tích của 0,15 mol khí ở đktc là: V O = 0,15.22,4 = 3,36 (lít).
Thực tế, sau phản ứng V = 5,6 lít.
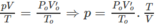
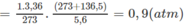
2. Giả sử C x H y O có PTK nhỏ hơn C x ' H y ' O ; như vậy số mol C x H y O sẽ là O 2 và số mol C x ' H y ' O là 0,01.
Số mol C O 2 sẽ là 0,02x + 0,01x' = 0,05 (mol) hay 2x + x' = 5.
x và x' là số nguyên: x = 1 ; x' = 3
hoặc x = 2; x' = 1
Cặp x = 2; x' = 1 loại vì trái với điều kiện: C x H y O có PTK nhỏ hơn C x ' H y ' O
Vậy, một ancol là C H 4 O và chất còn lại C 3 H y ' O .
Số mol H 2 O là 0,02.2 + 0,01.(y′/2) = 0,07 (mol).
⇒ y' = 6 ⇒ Ancol còn lại là C 3 H 6 O .
% về khối lượng của C H 4 O hay C H 3 - O H (ancol metylic) :

% về khối lượng của C 3 H 6 O hay C H 2 = C H - C H 2 - O H (a- Oncol anlylic): 100,00% - 52,46% = 47,54%.

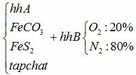
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
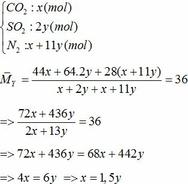
Khối lượng Fe có trong Z là:
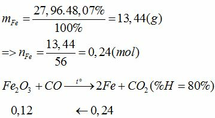
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
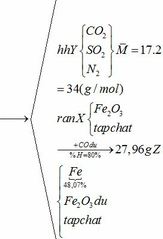
b) hỗn hợp Y gồm:
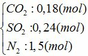
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
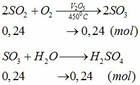
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
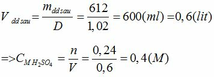

1) nh2=0,2; n CACO3=0,7
pt1: CH4+2O2 ---> CO2+2H2O
x x
pt2: C2H4 +3O2 ----> 2CO2+2H2O
y 2y
pt3: CO2+CA(OH)2 ----> CACO3+H2O
0,7 0,7
ta có hệ pt: x+y=0,2
x+2y=0,7
tự tìm
b) nbr2=1
pt: C4H6+ 2Br2 -----> C4H6Br4
0,05 0,1 0,05
tỉ lệ: 0,3/1 > 0,1/2 => C4H6 dư
CM C4H6Br2=0,05/8,72
CM C4H6 dư= 0,25/8,72

Gọi x, y lần lượt là số mol của Cu và Fe.
Ta có: \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
a. PTHH: 2Cu + O2 ---to---> 2CuO (1)
3Fe + 2O2 ---to---> Fe3O4 (2)
Ta có: \(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
Theo PT(1): \(n_{Cu}=n_{CuO}=0,2\left(mol\right)\)
Theo PT(1): \(n_{O_2}=\dfrac{1}{2}.n_{Cu}=\dfrac{1}{2}x\left(mol\right)\)
Theo PT(2): \(n_{O_2}=\dfrac{2}{3}.n_{Fe}=\dfrac{2}{3}y\left(mol\right)\)
=> \(\dfrac{1}{2}x+\dfrac{2}{3}y=0,3\)
Mà nCu = 0,2(mol)
Thay vào, ta được: \(\dfrac{1}{2}.0,2+\dfrac{2}{3}y=0,3\)
=> y = 0,3(mol)
=> \(m_{Cu}=0,2.64=12,8\left(g\right)\)
\(m_{Fe}=0,3.56=16,8\left(g\right)\)
b. \(\%_{Cu}=\dfrac{12,8}{12,8+16,8}.100\%=43,24\%\)
\(\%_{Fe}=100\%-43,24\%=56,76\%\)

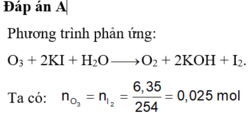
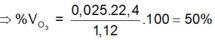
Gọi \(n_{O_3\left(pư\right)}=a\left(mol\right)\left(đk:a>0\right)\)
PTHH: \(2Ag+O_3\rightarrow Ag_2O+O_2\uparrow\)
a---------------->a
\(m_{tăng}=m_{O_3\left(pư\right)}-m_{O_2\left(sinh.ra\right)}=48a-32a=1,28\\ \Leftrightarrow a=0,08\left(mol\right)\left(TM\right)\\ n_X=\dfrac{44,8}{22,4}=2\left(mol\right)\\ \rightarrow\%V_{O_3}=\dfrac{0,08}{2}.100\%=8\%\)