Hỗn hợp khí gồm CH4 và C2H6 có tỉ khối đối với hiđro là 13,25.
a/ Tính % thể tích từng khí trong hỗn hợp.
b/ Tính % khối lượng nguyên tố hiđro trong hỗn hợp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(\overline{M}_A=5,875.2=11,75\left(g/mol\right)\)
b) Gọi số mol N2, H2 là a, b (mol)
\(\overline{M}_A=\dfrac{28a+2b}{a+b}=11,75\left(g/mol\right)\)
=> 16,25a = 9,75b
=> a = 0,6b
\(\left\{{}\begin{matrix}\%n_{N_2}=\dfrac{a}{a+b}.100\%=\dfrac{0,6b}{0,6b+b}.100\%=37,5\%\\\%n_{H_2}=\dfrac{b}{a+b}.100\%=\dfrac{b}{0,6b+b}.100\%=62,5\%\end{matrix}\right.\)
c)
1 mol hỗn hợp A chứa \(\left\{{}\begin{matrix}n_{N_2}=\dfrac{1.37,5}{100}=0,375\left(mol\right)\\n_{H_2}=\dfrac{1.62,5}{100}=0,625\left(mol\right)\end{matrix}\right.\)
\(\overline{M}_B=\dfrac{0,375.28+0,625.2+17x}{1+x}=6,4.2=12,8\left(g/mol\right)\)
=> x = 0,25 (mol)

a) Gọi nO2 =a (mol); nO3 = b(mol)
Có: \(\dfrac{32a+48b}{a+b}=20.2=40\)
=> 32a + 48b = 40a + 40b
=> 8a = 8b => a = b
=> \(\left\{{}\begin{matrix}\%V_{O_2}=\dfrac{a}{a+b}.100\%=\dfrac{a}{a+a}.100\%=50\%\\\%V_{O_3}=100\%-50\%=50\%\end{matrix}\right.\)
b) Gọi nN2 =a (mol); nNO = b(mol)
Có: \(\dfrac{28a+30b}{a+b}=14,75.2=29,5\)
=> 28a + 30b = 29,5a + 29,5b
=> 1,5a = 0,5b
=> 3a = b
=> \(\left\{{}\begin{matrix}\%V_{N_2}=\dfrac{a}{a+b}.100\%=\dfrac{a}{a+3a}.100\%=25\%\\\%V_{NO}=100\%-25\%=75\%\end{matrix}\right.\)

a) \(n_X=\dfrac{6.10^{23}}{6.10^{23}}=1\left(mol\right)\)
=> \(n_Y=0,5\left(mol\right)\)
Gọi số mol NO2, CH4 là a, b
=> a + b = 0,5
Có: \(\dfrac{46a+16b+0,5.M_Y}{1}=15.2\)
=> 46a + 16b + 0,5.MY = 30
Có: \(\dfrac{16b}{46a+16b+0,5.M_Y}.100\%=16\%\)
=> b = 0,3 (mol)
=> a = 0,2 (mol)
=> MY = 32(g/mol)
Mà Y là đơn chất
=> Y là O2
b) \(n_{CH_4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,5}{2}\)=> CH4 dư, O2 hết
=> Lượng O2 trong hỗn hợp trên không đủ để đốt cháy 6,72 lít CH4

\(a,V_{CH_4}=\dfrac{2}{2+3}.11,2=4,48\left(l\right)\\ V_{C_2H_6}=11,2-4,48=6,72\left(l\right)\\ n_{CH_4}=\dfrac{4,48}{22,4}=0,2\left(mol\right);n_{C_2H_6}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ b,m_{hh}=m_{CH_4}+m_{C_2H_6}=16.0,2+30.0,3=12,2\left(g\right)\)

Giả sử trong 1 mol A có x mol C n H 2 n và (1 - x) mol H 2 .
M A = 14nx + 2(1 - x) = 2.6 = 12 (g/mol) (1)
Khi đun nóng 1 mol A có mặt chất xúc tác Ni, tất cả anken đã chuyển hết thành ankan (vì B không làm mất màu nước brom).
C n H 2 n + H 2 → C n H 2 n + 2
x mol x mol x mol
Số mol khí trong hỗn hợp B là (1 - x)
Khối lượng hỗn hợp B = khối lượng hỗn hợp A = 12 (g). Do đó :

Thay x = 0,25 vào (1), tìm được n = 3.
Hỗn hợp A: C 3 H 6 25%; H2: 75%.
Hỗn hơp B:
C
3
H
8
: 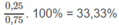
H 2 : 66,67%.

Trong 1 mol A có x mol 2 anken (có công thức chung là C n H 2 n ) và (1-x) mol H 2 :
M A = 14 n x + 2(1 - x) = 8,26.2 = 16,52 (g/mol). (1)
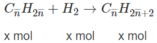
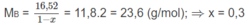
Thay x = 0,3 vào (1), tìm được n = 3,6.
Công thức của 2 anken là C 3 H 6 (a mol) và C 4 H 8 (b mol)
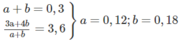
Hỗn hợp A: C 3 H 6 : 12%; C 4 H 8 : 18%; H 2 : 70%.
Hỗn hợp B:
C
3
H
8
: 
C
4
H
10
: 
H 2 chiếm 57%.

a) Gọi số mol H2, N2 trong A là a, b
Có \(\dfrac{2a+28b}{a+b}=9,125.2=18,25\)
=> a = 0,6b
\(\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{a}{a+b}.100\%=37,5\%\\\%V_{N_2}=\dfrac{b}{a+b}.100\%=62,5\%\end{matrix}\right.\)
b) \(n_A=\dfrac{14,6}{18,25}=0,8\left(mol\right)\)
c) \(n_A=\dfrac{6,2}{18,25}=\dfrac{124}{365}\left(mol\right)\)
Gọi số mol H2 cần thêm là x
Có \(\dfrac{2x+6,2}{x+\dfrac{124}{365}}=7,5.2=15\)
=> x = 0,085 (mol)
=> mH2 = 0,085.2 = 0,17(g)
a) Mhh = 13,25.2 = 26,5 (g/mol
Áp dụng sơ đồ đường chéo:
\(\dfrac{V_{CH_4}}{V_{C_2H_6}}=\dfrac{30-26,5}{26,5-16}=\dfrac{1}{3}\\ \rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{1}{1+3}.100\%=25\%\\\%V_{C_2H_6}=100\%-25\%=75\%\end{matrix}\right.\)
b) \(\%H=\dfrac{4+3.6}{16+3.30}.100\%=20,75\%\)