Cho a gam kim loại Kẽm vào 400 ml dung dịch HCl.Sau khi phản ứng kết thúc thu được 2,24 lít khí H2 (ở đktc)
a.Viết PTHH xảy ra
b.Tính a
c.Tính nồng độ mol/lít của dung dịch HCl đã tham gia phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,3.65=19,5\left(g\right)\)
c, \(n_{HCl}=2n_{H_2}=0,6\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{0,6}{0,1}=6\left(M\right)\)

a, PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2SO_4}=n_{ZnCl_2}=n_{H_2}=0,15\left(mol\right)\)
b, mZn = 0,15.65 = 9,75 (g)
c, CM (H2SO4) = 0,15/0,05 = 3 M
d, mZnSO4 = 0,15.161 = 24,15 (g)
Bạn tham khảo nhé!

a. PTHH:
\(Zn+H_2SO_4--->ZnSO_4+H_2\uparrow\)
\(Cu+H_2SO_4--\times-->\)
b. Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2SO_4}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,1}{\dfrac{200}{1000}}=0,5M\)
c. Ta có: \(m_{Zn}=0,1.65=6,5\left(g\right)\)
\(\Rightarrow m_{Cu}=10,5-6,5=4\left(g\right)\)

Đáp án D
Nhận thấy ở hai thí nghiệm có lượng kim loại tham gia phản ứng như nhau, lượng HCl sử dụng lớn hơn lượng HCl sử dụng ở thí nghiệm 1 nhưng lượng H2 ở hai thí nghiệm thu được như nhau.
Do đó ở thí nghiệm 2 HCl phản ứng dư, thí nghiệm 1 có HCl phản ứng đủ hoặc dư.
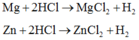
Có
![]()
Quan sát 4 đáp án nhận thấy chỉ có giá trị 0,3 là phù hợp.

Ta có: \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
____0,1______0,2_____0,1____0,1 (mol)
a, \(C_{M_{HCl}}=\dfrac{0,2}{0,15}=\dfrac{4}{3}\left(M\right)\)
\(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
b, \(FeCl_2+2NaOH\rightarrow2NaCl+Fe\left(OH\right)_2\)
Theo PT: \(n_{NaOH}=2n_{FeCl_2}=0,2\left(mol\right)\)
\(\Rightarrow V_{NaOH}=\dfrac{0,2}{2}=0,1\left(l\right)\)

a) PTHH: Zn + H2SO4 -> ZnSO4 + H2
nH2= 0,15(mol)
=> nZn=nH2SO4=nZnSO4=nH2=0,15(mol)
b) mZn=0,15.65=9,75(g)
c) CMddH2SO4= 0,15/ 0,05=3(M)
d) mZnSO4= 161. 0,15=24,15(g)

\(n_{KMnO_4}=\frac{15,8}{158}=0,1\left(mol\right)\)
PTHH : \(2KMnO_4+16HCl-->2KCl+2MnCl_2+5Cl_2+8H_2O\) (1)
\(Cl_2+H_2-as->2HCl\) (2)
Có : \(m_{ddHCl}=100\cdot1,05=105\left(g\right)\)
=> \(m_{HCl}=105-97,7=7,3\left(g\right)\)
=> \(n_{HCl}=\frac{7,3}{36,5}=0,2\left(mol\right)\)
BT Clo : \(n_{Cl_2}=\frac{1}{2}n_{HCl}=0,1\left(mol\right)\)
Mà theo lí thuyết : \(n_{Cl_2}=\frac{5}{2}n_{KMnO_4}=0,25\left(mol\right)\)
=> \(H\%=\frac{0,1}{0,25}\cdot100\%=40\%\)
Vì spu nổ thu được hh hai chất khí => \(\hept{\begin{cases}H_2\\HCl\end{cases}}\) (Vì H2 dư)
=> \(n_{hh}=\frac{13,44}{22,4}=0,6\left(mol\right)\)
=> \(n_{H_2\left(spu\right)}=n_{hh}-n_{HCl\left(spu\right)}=0,6-0,2=0,4\left(mol\right)\)
BT Hidro : \(\Sigma_{n_{H2\left(trong.binh\right)}}=n_{H_2\left(spu\right)}+\frac{1}{2}n_{HCl}=0,4+0,1=0,5\left(mol\right)\)
đọc thiếu đề câu a wtf
\(C_{M\left(HCl\right)}=\frac{0,2}{0,1}=2\left(M\right)\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 ( mol )
\(m_{Zn}=0,1.65=6,5g\)
\(C_{MddHCl}=\dfrac{0,2}{0,4}=0,5M\)
Lời giải đâu ko có thấy