nêu trạng thái tự nhiên halogen, trình bày các phương pháp điều chế các đơn chất của Halogen
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


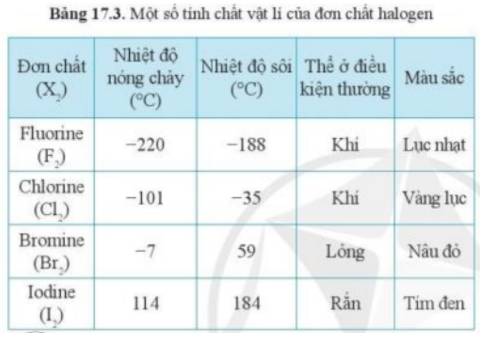
Trong các đơn chất halogen, chất điều kiện thường ở trạng thái rắn là I 2 .
Chọn đáp án D.

- Theo bảng 17.3, xu hướng biến đổi trạng thái của các halogen ở điều kiện thường từ: khí → lỏng → rắn
- Mà astatine đứng dưới cùng trong nhóm halogen
=> Astatine tồn tại ở thể rắn trong điều kiện thường
- Giải thích: Do sự tăng khối lượng phân tử và sự tăng tương tác van dể Waals

Đáp án B
3-có tính oxi hóa mạnh;
5-có 7e lớp ngoài cùng;
6-các nguyên tố halogen không có ở trạng thái tự do trong tự nhiên

Trong các đơn chất halogen, chất ở trạng thái lỏng là B r 2 .
Chọn đáp án C.

Các nguyên tố halogen không có ở trạng thái tự do trong thiên nhiên do nguyên tử của các nguyên tố này hoạt động này hoạt động hóa học rất mạnh.

Khi tan trong nước, các halogen tác dụng với nước, flo phản ứng mãnh liệt với nước giải phóng oxi.
2F2 + 2H2O → 4HF + O2.
Với brom và clo thì phản ứng xảy ra theo hướng khác, brom tác dụng với nước chậm hơn.
Br2 + H2O ⇆ HBr + HBrO.
Cl2 + H2O ⇆ HCl + HClO
Iot không phản ứng với nước

+) flo phân hủy nước ngay ở nhiệt độ thấp :2F2+2H2O--->4HF+O2
+)Clo,Brom phản ứng chậm với nướctheo phản ứng thuận nghịch:Cl2+H2O<-->HCl+HClO,Br2+H2O<--->HBr+HBrO.
+)iot hầu như không phản ứng với nước.
- Trong tự nhiên, các halogen tồn tại ở dạng hợp chất
- Điều chế:
+ F2: Điện phân hỗn hợp KF, HF
+ Cl2:
* Cho HCl đặc tác dụng với chất oxh mạnh như MnO2, KMnO4,..
* Điện phân dung dịch NaCl
+ Br2: Dùng Cl2 để oxh NaBr thành Br2
+ I2: Điều chế từ rong biển