Cho 0,15 mol nhôm vào đúng dịch 0,05mol axit Clohiđric. a,viết phương trình và tính thể tích khí hiđro thu được ở điều kiện tiêu chuẩn. b, tính khối lượng chất còn dư sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


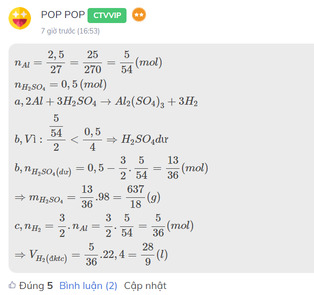
\(n_{Al}=\dfrac{2,5}{27}=\dfrac{25}{270}=\dfrac{5}{54}\left(mol\right)\\ n_{H_2SO_4}=0,5\left(mol\right)\\ a,2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ b,Vì:\dfrac{\dfrac{5}{54}}{2}< \dfrac{0,5}{4}\Rightarrow H_2SO_4dư\\ b,n_{H_2SO_4\left(dư\right)}=0,5-\dfrac{3}{2}.\dfrac{5}{54}=\dfrac{13}{36}\left(mol\right)\\ \Rightarrow m_{H_2SO_4}=\dfrac{13}{36}.98=\dfrac{637}{18}\left(g\right)\\ c,n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.\dfrac{5}{54}=\dfrac{5}{36}\left(mol\right)\\ \Rightarrow V_{H_2\left(đktc\right)}=\dfrac{5}{36}.22,4=\dfrac{28}{9}\left(l\right)\)

a: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b: \(n_{Al}=\dfrac{2.5}{27}< \dfrac{1}{4}\)
=>H2SO4 dư, Al đủ
\(m_{H_2SO_4}=0.25\cdot98=24.5\left(g\right)\)
c: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{2.5}{54}=\dfrac{5}{108}\left(mol\right)\)
\(\Leftrightarrow n_{H_2}=\dfrac{5}{36}\left(mol\right)\)
\(V_{H_2}=\dfrac{5}{36}\cdot22.4=\dfrac{28}{9}\left(lít\right)\)
Mình thấy bạn Thịnh tính lượng dư sai
Đây là bài mình từng làm, bạn tham khảo nhé!

PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
Làm gộp các phần còn lại
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{Al_2\left(SO_4\right)_3}=0,1mol\\n_{H_2SO_4}=n_{H_2}=0,3mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,3\cdot22,4=6,72\left(l\right)\\m_{Al_2\left(SO_4\right)_3}=0,1\cdot342=34,2\left(g\right)\\m_{H_2SO_4}=0,3\cdot98=29,4\left(g\right)\end{matrix}\right.\)

a, PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Ta có: \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,1}{2}>\dfrac{0,25}{6}\), ta được Al dư.
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{HCl}=0,125\left(mol\right)\Rightarrow V_{H_2}=0,125.22,4=2,8\left(l\right)\)
b, Theo PT: \(n_{Al\left(pư\right)}=\dfrac{1}{3}n_{HCl}=\dfrac{1}{12}\left(mol\right)\Rightarrow n_{Al\left(dư\right)}=0,1-\dfrac{1}{12}=\dfrac{1}{60}\left(mol\right)\)
\(\Rightarrow m_{Al}=\dfrac{1}{60}.27=0,45\left(g\right)\)

\(n_{Fe}=\dfrac{28}{56}=0,5mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,5 1 0,5
\(V_{H_2}=0,5\cdot22,4=11,2l\)
\(m_{HCl}=1\cdot36,5=36,5g\)

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, Ta có: \(n_{Zn}=\dfrac{32,5}{65}=0,5\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,5\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,5.22,4=11,2\left(l\right)\)
c, Theo PT: \(n_{ZnCl_2}=n_{Zn}=0,5\left(mol\right)\)
\(\Rightarrow m_{ZnCl_2}=0,5.136=68\left(g\right)\)

Số mol của 5,6g Fe:
\(n_{Fe}=\dfrac{m}{M}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
a,\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
b,thể tích của 0,1 mol H2:
\(V_{H_2}=n.22,4=0,1.22,4=2,24\left(l\right)\)
c,\(H_2+CuO\underrightarrow{t^o}Cu+H_2O\)
khối lượng của 0,1 mol Cu:
\(m_{Cu}=n.M=0,1.64=6,4\left(g\right)\)

a)
\(Zn + 2HCl \to ZnCl_2 + H_2\)
b),c)
Theo PTHH :
\(n_{ZnCl_2} = n_{H_2} = n_{Zn} = \dfrac{13}{65} = 0,2(mol)\)
Vậy :
\(m_{ZnCl_2} = 0,2.136 = 27,2(gam)\\ V_{H_2} =0,2.22,4 = 4,48(lít)\)
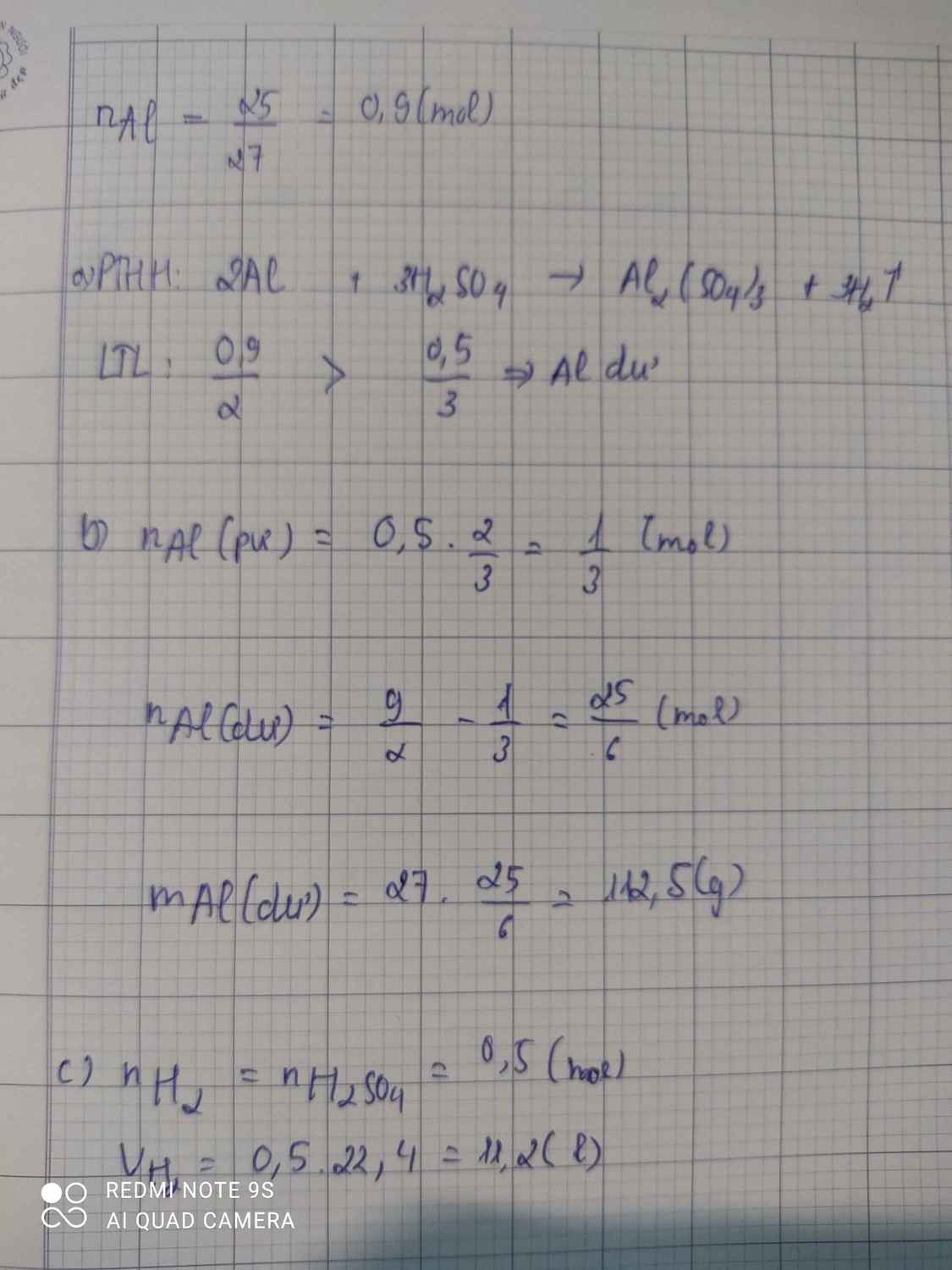
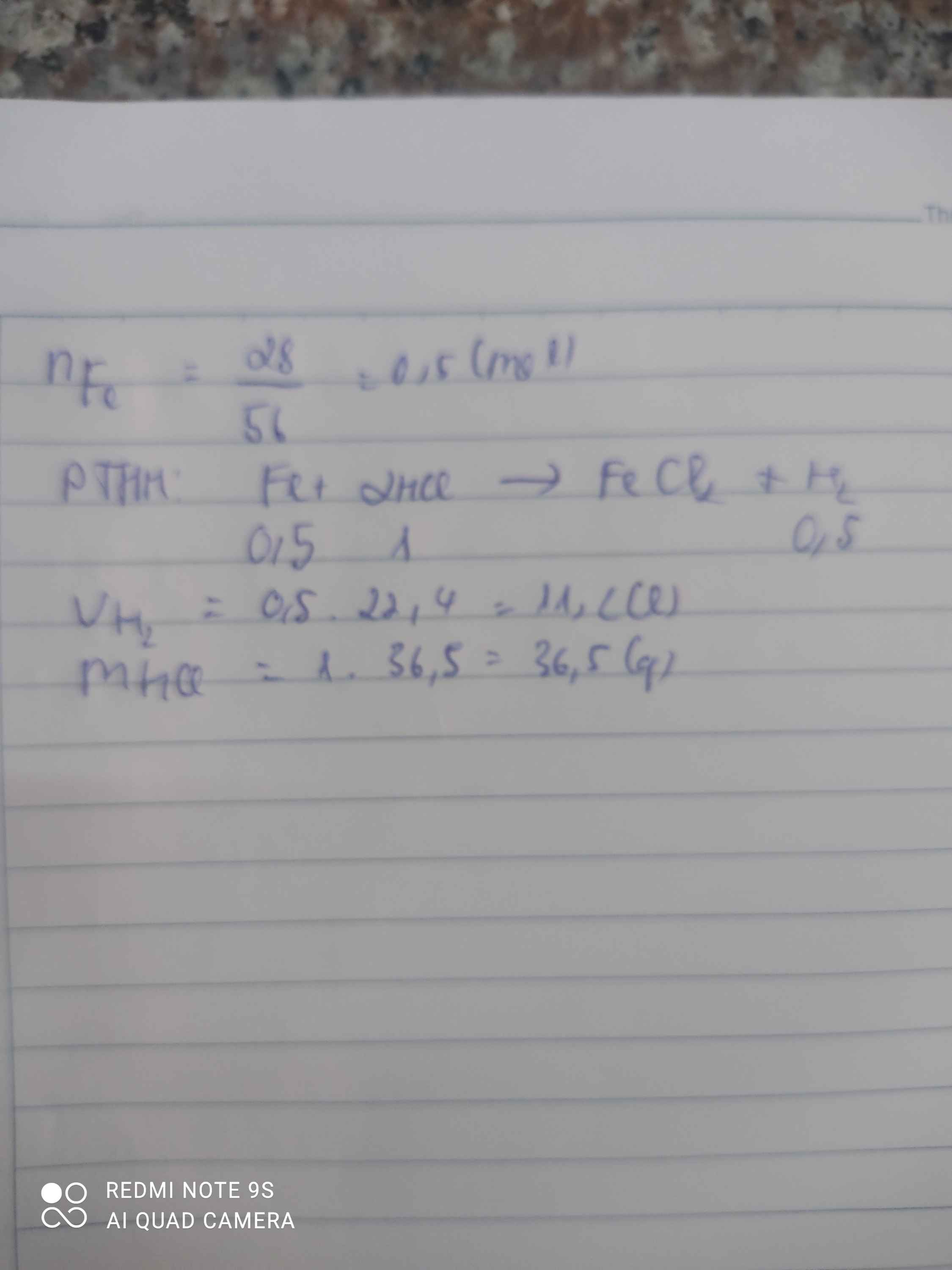
2Al+6HCl->2AlCl3+3H2
1\60--0,05---------------0,025
HCl dư
=>VH2=0,025.22,4=0,56l
=>m dư=\(\dfrac{2}{15}\).27=3,6g