Cho 28,8g hỗn hợp gồm Fe và S đem đun nóng. Sau phản ứng thu được hỗn hợp Y có tỉ khối với H2 là 9. Tính phần trăm khối lượng Fe trong hỗn hợp ban đầu?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 1:
a+b) PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)=n_{Fe}\)
\(\Rightarrow m_{Fe}=0,2\cdot56=11,2\left(g\right)\) \(\Rightarrow m_{Cu}=6,4\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{11,2}{17,6}\cdot100\%\approx63,64\%\\\%m_{Cu}=36,36\%\end{matrix}\right.\)
c) Ta có: \(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
Bảo toàn nguyên tố: \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)=n_{CuSO_4}\)
\(\Rightarrow m_{muối}=0,1\cdot400+0,1\cdot160=56\left(g\right)\)
Bài 2:
Quy đổi hh gồm Fe (a mol) và O (b mol)
\(\Rightarrow56a+16b=27,6\) (1)
Ta có: \(n_{SO_2}=\dfrac{5,04}{22,4}=0,225\left(mol\right)\)
Bảo toàn electron: \(3n_{Fe}=2n_O+2n_{SO_2}\) \(\Rightarrow3a-2b=0,45\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,39\\b=0,36\end{matrix}\right.\)
Bảo toàn nguyên tố: \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,195\left(mol\right)\) \(\Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,195\cdot400=78\left(g\right)\)

Chọn A
Gọi số mol của Fe 2 O 3 và FeO lần lượt là x và y (mol)
Theo bài ra: m X = 9,02 → 160x + 72y + 5,1 = 9,02 → 160x + 72y = 3,92 (1)
Cho X phản ứng với CO dư, đun nóng Al 2 O 3 không phản ứng.
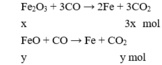
Cho hỗn hợp khí qua nước vôi trong chỉ CO 2 phản ứng
Theo bài ra:
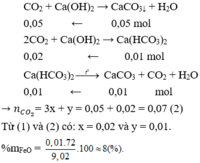

Gọi hh khí ban đầu là X và hh khí sản phẩm là Y.
\(d_{\dfrac{X}{H_2}}=3,6\rightarrow M_X=3,6.2=7,2\left(\dfrac{g}{mol}\right)\)
Ta có:
\(\dfrac{n_{N_2}}{n_{H_2}}=\dfrac{7,2-2}{28-7,2}=\dfrac{5,2}{20,8}=\dfrac{1}{4}\) ( quy tắc đường chéo )
Gọi x là số mol N2 tham gia phản ứng.
PTHH:
\(N_2+3H_2\xrightarrow[Fe]{t^o}2NH_3\)
Trc p/ư: 1 4
p/ư: x 3x 2x (mol)
sau p/ư: 1-x 4-3x 2x
\(\rightarrow n_Y=1-x+4-3x+2x=5-2x\left(mol\right)\)
\(d_{\dfrac{Y}{H_2}}=4,5\rightarrow M_Y=4,5.2=9\left(\dfrac{g}{mol}\right)\)
BTKL: mX = mY
\(m_Y=1.28+4.2=36\left(g\right)\)
\(\rightarrow\dfrac{36}{9}=5-2x\)
\(\rightarrow x=0,5\)
Giả sử phản ứng xảy ra hoàn toàn:
\(\dfrac{1}{1}< \dfrac{4}{3}\) --> N2 hết, H2 dư.
Trước:
\(\%V_{N_2}=\dfrac{1.22,4}{5.22,4}.100\%=20\%\)
\(\%V_{H_2}=100\%-20\%=80\%\)
Sau:
\(\%V_{NH_3}=\dfrac{1.22,4}{4.22,4}.100\%=25\%\)
\(\%V_{N_2}=\dfrac{\left(1-0,5\right).22,4}{4.22,4}.100\%=12,5\left(\%\right)\)
\(\%V_{H_2}=\dfrac{\left(4-1,5\right).22,4}{4.22,4}.100\%=62,5\%\)

Đáp án B
Áp dụng phương pháp đường chéo cho hỗn hợp X:
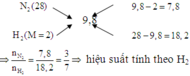
Cách 1: Gọi số mol N2 là 3x thì số mol H2 là 7x ⇒ tổng số mol hỗn hợp X là 3x + 7x = 10x
Thay vào công thức:
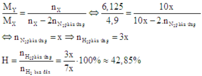
Cách 2: Áp dụng công thức tính nhanh với trường hợp x < 3y:
Hiệu suất phản ứng:
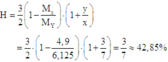

Số mol NaNO3 = 0,36 mol
số mol H2SO4 = 0,72 mol => số mol H+ = 1,44 mol
Ta có các bán phản ứng:
NO3- + 4H+ + 3e → NO + 2H2O (1)
mol 0,16 ← 4.0,16 0,16.3 ← 0,16
Số mol NO = 0,16 mol => H+ và NO3- dư, kim loại phản ứng hết.
Số mol NO3- phản ứng = 0,16 mol; số mol H+ phản ứng = 0,64 mol
Fe → Fe3+ + 3e(1)
Zn → Zn2+ + 2e(2)
Gọi số mol Fe là x mol, số mol Zn là y mol
Theo khối lượng hỗn hợp ban đầu ta có phương trình
56 x + 65 y = 10,62 (I)
Theo định luật bảo toàn electron ta có phương trình
3x + 2y = 0,16.3 (II)
Giải hệ phương trình (I), (II) ta có: x = 0,12 và y = 0,06 mol
mFe = 0,12.56 = 6,72 g => % mFe = 63,28%

a) PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\) (1)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\) (2)
b) Ta có: \(\Sigma n_{H_2}=\dfrac{3,024}{22,4}=0,135\left(mol\right)\)
Gọi số mol của Fe là \(a\) \(\Rightarrow n_{H_2\left(1\right)}=a\)
Gọi số mol của Al là \(b\) \(\Rightarrow n_{H_2\left(2\right)}=\dfrac{3}{2}b\)
Ta lập được hệ phương trình:
\(\left\{{}\begin{matrix}a+\dfrac{3}{2}b=0,135\\56b+27b=4,14\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,045\\b=0,06\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,045\cdot56=2,52\left(g\right)\\m_{Al}=1,62\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{2,52}{4,14}\cdot100\%\approx60,87\%\\\%m_{Al}=39,13\%\end{matrix}\right.\)
c) PTHH: \(FeCl_2+2NaOH\rightarrow2NaCl+Fe\left(OH\right)_2\downarrow\)
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3\downarrow+3NaCl\)
\(4Fe\left(OH\right)_2+O_2\underrightarrow{t^o}2Fe_2O_3+4H_2O\)
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
Theo các PTHH: \(\left\{{}\begin{matrix}n_{Fe\left(OH\right)_2}=n_{FeCl_2}=0,045mol\\n_{Al\left(OH\right)_3}=n_{AlCl_3}=0,06mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Fe_2O_3}=0,0225mol\\n_{Al_2O_3}=0,03mol\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe_2O_3}=0,0225\cdot160=3,6\left(g\right)\\m_{Al_2O_3}=0,03\cdot102=3,06\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{chấtrắn}=3,06+3,6=6,66\left(g\right)\)



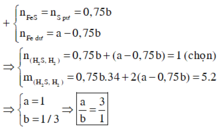
Gọi số mol Fe, S là a, b (mol)
=> 56a + 32b = 28,8 (1)
Do hỗn hợp Y chứa H2S, H2
=> Fe dư, S hết
PTHH: Fe + S --to--> FeS
b<---b------->b
Fe + 2HCl --> FeCl2 + H2
(a-b)------------------->(a-b)
FeS + 2HCl --> FeCl2 + H2S
b------------------------>b
=> \(\overline{M}_Y=\dfrac{2\left(a-b\right)+34b}{a-b+b}=9.2=18\left(g/mol\right)\)
=> a = 2b (2)
(1)(2) => a = 0,4 (mol); b = 0,2 (mol)
\(\%m_{Fe}=\dfrac{0,4.56}{28,8}.100\%=77,78\%\)
HCl đâu ra z?