bài 1 nhiệt phân 49 g KClO3 thu được ở lượng khí o2 a tính thể tích o2 sinh ra ở điều kiện tiêu chuẩn b đốt cháy 12,4 g photpho với toàn bộ thể tích o2 sinh ra ở trên + chất nào dư dư bao nhiêu mol +tính khối lượng p2o 5 tạo thành bài 2 : nhiệt phân 126,4 g KMnO4 thu được ở lượng khí o2 tính thể tích o2 sinh ra ở điều kiện tiêu chuẩn đốt cháy 12,4 g photpho với toàn bộ thể tích o2 sinh ra ở trên + chất nào dư dư bao nhiêu mol + tính khối lượng p2o5 tạo thành giúp em với ạ chiều em thi rồi ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, PT: \(2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\)
Ta có: \(n_{KClO_3}=\dfrac{73,5}{122,5}=0,6\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,9\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,9.22,4=20,16\left(l\right)\)
b, PT: \(2Mg+O_2\underrightarrow{t^o}2MgO\)
Ta có: \(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,3}{2}< \dfrac{0,9}{1}\), ta được O2 dư.
Theo PT: \(n_{MgO}=n_{Mg}=0,3\left(mol\right)\)
\(\Rightarrow m_{MgO}=0,3.40=12\left(g\right)\)
Bạn tham khảo nhé!

\(a/n_{Fe}=\dfrac{2,52}{56}=0,045mol\\ 3Fe+2O_2\xrightarrow[]{t^0}Fe_3O_4\\ n_{O_2}=\dfrac{0,045.2}{3}=0,03mol\\ V_{O_2}=0,03.22,4=0,672l\\ b/2KClO_3\xrightarrow[]{t^0}2KCl+3O_2\\ n_{KClO_3}=\dfrac{0,03.2}{3}=0,02mol\\ m_{KClO_3}=0,02.122,5=2,45g\)

Bài 1:
a) PTHH: CH4 + 2O2 ---to→ CO2 + 2H2O
Mol: 1 2
\(V_{O_2}=2.22,4=44,8\left(l\right)\)
b)
PTHH: 2C4H10 + 13O2 ---to→ 8CO2 + 10H2O
Mol: 1 6,5
\(V_{O_2}=6,5.22,4=145,6\left(l\right)\)
Bài 2:
PTHH: 2KClO3 ---to (MnO2)→ 2KCl + 3O2
Mol: 1 1,5
PTHH: 2KMnO4 ---to→ K2MnO4 + MnO2 + O2
Mol: 1 0,5
⇒ KClO3 thu đc thể tích khí O2 lớn hơn (do 1,5 > 0,5)

a) nKMnO4=0,01(mol)
PTHH: 2 KMnO4 -to-> K2MnO4 + MnO2 + O2
0,01______________0,005_____0,005___0,005(mol)
V(O2,đktc)=0,005.22,4=0,112(l)
b) PTHH: 2 Cu + O2 -to-> 2 CuO
nCu=0,1(mol); nO2=0,005(mol)
Ta có: 0,1/2 > 0,005/1
=> Cu dư, O2 hết, tính theo nO2.
nCu(p.ứ)=2.0,005=0,01(mol)
=> nCu(dư)=0,1-0,01=0,09(mol)
=>mCu(dư)=0,09.64=5,76(g)

a, PT: \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b, Ta có: \(n_{P_2O_5}=\dfrac{7,1}{142}=0,05\left(mol\right)\)
Theo PT: \(n_P=2n_{P_2O_5}=0,1\left(mol\right)\)
\(\Rightarrow m_P=0,1.31=3,1\left(g\right)\)
\(n_{O_2}=\dfrac{5}{2}n_{P_2O_5}=0,125\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,125.22,4=2,8\left(l\right)\)
c, Có: \(V_{O_2\left(dư\right)}=2,8.15\%=0,42\left(l\right)\)
\(\Rightarrow V_{O_2}=2,8+0,42=3,22\left(l\right)\)

\(n_{KClO_3}=\dfrac{24.5}{122.5}=0.2\left(mol\right)\)
\(2KClO_3\underrightarrow{t^0}2KCl+3O_2\)
\(0.2.............0.2.........0.3\)
\(m_{KCl}=0.2\cdot74.5=14.9\left(g\right)\)
\(V_{O_2}=0.3\cdot22.4=6.72\left(l\right)\)
\(n_{_{ }O_2}=\dfrac{33.6}{22.4}=1.5\left(mol\right)\)
\(\Rightarrow n_{KClO_3}=1.5\cdot\dfrac{2}{3}=1\left(mol\right)\)
\(m_{KClO_3}=122.5\left(g\right)\)
a) \(2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\)
b) \(n_{KCl} = n_{KClO_3} = \dfrac{24,5}{122,5} = 0,2(mol)\\ \Rightarrow m_{KCl} = 0,2.74,5 = 14,9(gam)\)
c)
\(n_{O_2} = \dfrac{3}{2}n_{KClO_3} = 0,3(mol)\\ \Rightarrow V_{O_2} = 0,3.22,4 = 6,72(lít)\)
d)
\(n_{KClO_3} = \dfrac{2}{3}n_{O_2} = \dfrac{2}{3}.\dfrac{33,6}{22,4} = 1(mol)\\ \Rightarrow m_{KClO_3} = 1.122,5 = 122,5(gam)\)

2KMnO4 --to--> MnO2 + O2 + K2MnO4
0,6 <------------------------- 0,3 (mol)
a) nO2 = V/22,4 = 6,12/22,4 ≃ 0,3 (mol)
=> mKMnO4 = n . M = 0,6 . 158 = 94,8 ( g)
b) *PT (a) thu được khí O2
3O2 + 4Al --to--> 2Al2O3
0,3 -> 0,4 (mol)
mO2 = 0,3 . 32 = 9,6 (g)
mAl = 0,4 . 27 = 10,8 (g)
Khối lượng chất rắn cần tìm:
mAl2O3 = mO2 + mAl = 9,6 + 10,8 = 20,4 (g)

\(n_{KClO_3}=\dfrac{29.4}{122.5}=0.24\left(mol\right)\)
\(2KClO_3\underrightarrow{^{^{t^0}}}2KCl+3O_2\)
\(0.24.....................0.36\)
KClO3 : Kali clorat
KCl : Kali clorua
\(V_{O_2}=0.36\cdot22.4=8.064\left(l\right)\)
\(b.\)
\(n_P=\dfrac{6.2}{31}=0.2\left(mol\right)\)
\(4P+5O_2\underrightarrow{^{^{t^0}}}2P_2O_5\)
Lập tỉ lệ :
\(\dfrac{0.2}{4}< \dfrac{0.36}{5}\) => O2 dư
\(n_{O_2\left(dư\right)}=0.36-0.2\cdot\dfrac{5}{4}=0.11\left(mol\right)\)
\(m_{O_2}=0.11\cdot32=3.52\left(g\right)\)
\(m_{P_2O_5}=0.1\cdot142=14.2\left(g\right)\)
Chúc em học tốt nhé !
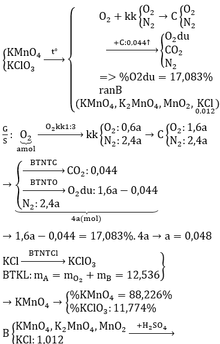
Bài 1.
a.\(n_{KClO_3}=\dfrac{49}{122,5}=0,4mol\)
\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,4 0,6 ( mol )
\(V_{O_2}=0,6.22,4=13,44l\)
b.\(n_P=\dfrac{12,4}{31}=0,4mol\)
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
\(\dfrac{0,4}{4}\)< \(\dfrac{0,6}{5}\) ( mol )
0,4 0,2 ( mol )
Chất dư là O2
\(m_{O_2\left(dư\right)}=0,6-\left(\dfrac{0,4.5}{4}\right)=0,1mol\)
\(m_{P_2O_5}=0,2.142=28,4g\)
Bài 2.
a.\(n_{KMnO_4}=\dfrac{126,4}{158}=0,8mol\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,8 0,4 ( mol )
\(V_{O_2}=0,4.22,4=8,96l\)
b.\(n_P=\dfrac{12,4}{31}=0,4mol\)
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
\(\dfrac{0,4}{4}\) > \(\dfrac{0,4}{5}\) ( mol )
0,4 0,16 ( mol )
Chất dư là P
\(n_{P\left(dư\right)}=0,4-\left(\dfrac{0,4.4}{5}\right)=0,08mol\)
\(m_{P_2O_5}=0,16.142=22,72g\)
b ơi , bài 2 phần PTHH 0,4 mol là của o2 phải không ạ ?