Cho kim loại X (hóa trị III) tác dụng với dung dịch HCl vừa đủ rồi cô cạn dung dịch sau phản ứng, thu được a gam muối khan. Nếu lấy cùng lượng X như trên cho tác dụng với dd H2SO4 loãng vừa đủ rồi cô cạn dung dịch, thì thu được b gam muối khan. Lập biểu thức tính số mol X theo a, b.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(X+H_2SO_4\rightarrow XSO_4+H_2\\Tacó: n_X=n_{XSO_4}\\ \Rightarrow\dfrac{7,2}{X}=\dfrac{36}{X+96}\\ \Rightarrow X=24\left(Magie-Mg\right)\)
\(n_X=\dfrac{7,2}{M_X}\left(mol\right)\)
PTHH: X + H2SO4 --> XSO4 + H2
____\(\dfrac{7,2}{M_X}\)----------->\(\dfrac{7,2}{M_X}\)
=> \(\dfrac{7,2}{M_X}\left(M_X+96\right)=36=>M_X=24\left(g/mol\right)\)
=> X là Mg (Magie)

\(n_X=\dfrac{7,2}{M_X}\left(mol\right)\)
PTHH: X + H2SO4 --> XSO4 + H2
____\(\dfrac{7,2}{M_X}\)------------->\(\dfrac{7,2}{M_X}\)
\(\dfrac{7,2}{M_X}\left(M_X+96\right)=36=>M_X=24\left(Mg\right)\)

Đáp án C
Sơ đồ phản ứng:
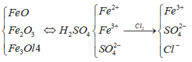
Khối lượng muối tăng là do có thêm lượng Cl-.
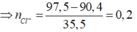
Ta thấy, Fe2+ phản ứng với Cl2.
![]()
Trong 90,4 gam muối khan có FeSO4 và Fe2(SO4)3.
Ta có:
![]()
Quy đổi hỗn hợp đầu về FeO và Fe2O3.
Khối lượng hỗn hợp là: m = 0,2×72 + 0,15×160 = 38,4

Đáp án D
Do X đơn chức nên X phản ứng với NaOH tỉ lệ 1:1 (không thể là trường hợp este của phenol vì số cacbon là 5)

Do hợp chất Z không phân nhánh nên vòng X cũng không có nhánh

Đáp án A
nHCl = 1,2 (mol)
Oxit + 2HCl →Muối + H2O
1,2 → 0,6 (mol)
Bảo toàn khối lượng:
moxit + m HCl = m muối + m nước
37,6 + 1,2.36,5 = m muối + 0,6.18
mmuối = 70,6 (g)

Viết phương trình hoá học của XCO3 và Y2(CO3)3 với dung dịch HCl và rút ra nhận xét :
nCO2=nH2O;
naxit=2nCO2
Áp dụng định luật bảo toàn khối lượng, ta có :
m2 muối cacbonat + maxit = m2 muối clorua + mCO2 + mH20
m2 muối clorua = 10 + (0,03 x 2 x 36,5) – (0,03 x 44) – (0,03 x 18) = 10,33 (gam)


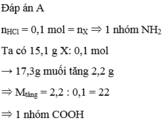
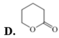
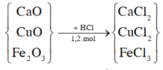
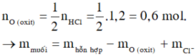
\(n_{XCl_3}=\dfrac{a}{M_X+106,5}\left(mol\right)\)
PTHH: 2X + 6HCl --> 2XCl3 + 3H2
=> \(n_X=\dfrac{a}{M_X+106,5}\left(mol\right)\)
\(n_{X_2\left(SO_4\right)_3}=\dfrac{b}{2.M_X+288}\left(mol\right)\)
PTHH: 2X + 3H2SO4 --> X2(SO4)3 + 3H2
=> \(n_X=\dfrac{b}{M_X+144}\left(mol\right)\)