Bài 6: Nung nóng Kali pemanganat KMnO4 thu được K2MnO4, MnO2 và khí O2. Hãy tính khối lượng KMnO4 cần thiết để điều chế 16,8 lít khí oxi (đktc).
Bài 7: a, Tính số gam sắt và oxi cần dung để điều chế 4,64g oxit sắt từ Fe3O4. b, Tính số gam Kali clorat KClO3 cần dùng để có lượng oxi dùng cho phản ứng trên.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Phương trình hóa học của phản ứng:
3Fe + 2O2 → Fe3O4.
nFe3O4 = 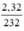 = 0,01 mol.
= 0,01 mol.
nFe = 3.nFe3O4 = 0,01 .3 = 0,03 mol.
nO2 = 2.nFe3O4 = 0,01 .2 = 0,02 mol.
mFe = 0,03.56 = 1,68g.
mO2 = 0,02.32 = 0,64g.
b) Phương trình phản ứng nhiệt phân KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2
nKMnO4 = 2.nO2 = 0,02.2 = 0,04 mol.
mKMnO4 = 0,04 .158 = 6,32g.

a, PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Ta có: \(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
Theo PT: \(n_{Fe}=3n_{Fe_3O_4}=0,03\left(mol\right)\Rightarrow m_{Fe}=0,03.56=1,68\left(g\right)\)
\(n_{O_2}=2n_{Fe_3O_4}=0,02\left(mol\right)\Rightarrow m_{O_2}=0,02.32=0,64\left(g\right)\)
b, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Theo PT: \(n_{KMnO_4}=2n_{O_2}=0,04\left(mol\right)\Rightarrow m_{KMnO_4}=0,04.158=6,32\left(g\right)\)

2KMnO4 = K2MnO4+MnO2+ O2 (1)
3Fe+ 2O2=(t0)Fe3O4 (2)
nFe3O4=2,32/232=0,01 mol
nO2=2nFe3O4=0,02 mol --> mO2=0,02. 32=0,64 g
nFe= 3nFe3O4=0,03 mol --> mFe=0,03.56=1,68 g
Ta có: nO2(1)=nO2(2)= 0,02 mol --> nKMnO4=2nO2=2. 0,02=0,04 mol => mKMnO4= 0,04. 158=6,32 g
xin lỗi nhé anh nhầm bước cuôi nKMnO4=2NO2=0.04 mol
=> mKMnO4=0.04*158=6.32g
Xin lỗi nhé

Bạn tách ra từng câu nhé!
Bài 3.
\(n_{Fe}=\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{36}{56}=0,6428mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,6428 ----- 0,4285 ( mol )
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,857 0,4285 ( mol )
\(m_{KMnO_4}=n_{KMnO_4}.M_{KMnO_4}=0,857.158=135,406g\)
Bài 4.
a.\(n_{Al_2O_3}=\dfrac{m_{Al_2O_3}}{M_{Al_2O_3}}=\dfrac{51}{102}=0,5mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
1 0,75 0,5 ( mol )
\(m_{Al}=n_{Al}.M_{Al}=1.27=27g\)
\(V_{O_2}=n_{O_2}.22,4=0,75.22,4=16,8l\)
b.\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
1,5 0,75 ( mol )
\(m_{KMnO_4}=n_{KMnO_4}.M_{KMnO_4}=1,5.158=237g\)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
0,5 0,75 ( mol )
\(m_{KClO_3}=n_{KClO_3}.M_{KClO_3}=0,5.122,5=61,25g\)

14/
\(2KMnO_4\rightarrow KMnO_2+MnO_2+O_2\uparrow\)
\(nO_2=\dfrac{13,95}{24,79}=0,6\left(mol\right)\)
\(\Rightarrow nO_2=\dfrac{1}{2}nKMnO_4\Rightarrow nKMnO_4=0,12\left(mol\right)\)
\(mKMnO_4=0,12.\left(39+55+16.4\right)=18,96\left(g\right)\)
15/
\(nCu=\dfrac{12,8}{64}=0,2\left(mol\right)\)
\(nO_2=\dfrac{8,37}{24,79}=0,3\left(mol\right)\)
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
\(Xéttỉlệ:\) \(\dfrac{nCu}{2}< \dfrac{nO_2}{1}\left(\dfrac{0,2}{2}=0,1< \dfrac{0,3}{1}=0,3\right)\)
=> O2 dư ; Cu đủ với pứ
Tính sô mol của CuO theo số mol của Cu
=> \(nCuO=nCu=0,2\left(mol\right)\)
\(\Rightarrow mCuO=0,2.\left(64+16\right)=16\left(g\right)\)

Bài 4. 2\(KMnO_4\) ---> \(K_2MnO_4\) + \(MnO_2\) + \(O_2\) (Lập và cân bằng phương trình)
0,6 mol 0,3 mol 0,3 mol 0,3 mol
a. + Số mol của \(O_2\)
\(n_{O_2}\) = \(\dfrac{V}{22,4}\) = \(\dfrac{6,72}{22,4}\) = 0,3 (mol)
+ Khối lượng của \(KMnO_4\) (thuốc tím) cần dùng:
\(m_{KMnO_4}\) = n . M = 0,6 . 158 = 94,8 (g)
b. 2\(KClO_3\) ---> 2\(KCl\) + 3\(O_2\) (Lập và cân bằng phương trình)
0,2 mol 0,2 mol 0,3 mol
Số g \(KClO_3\) dùng để điều chế:
\(m_{KClO_3}\) = n . M = 0,2 . 122,5 = 24,5 (g)
c. 2Cu + \(O_2\) ---> 2\(CuO\) (Lập và cân bằng phương trình)
0,6 mol 0,3 mol 0,6 mol
Số g của CuO sau phản ứng thu được:
\(m_{CuO}\) = n . M = 0,6 . 80 = 48 (g)
________________________________________
Bài 4 trước nha bạn, có gì sai thì nhắn mình :))
Bài 5. CuO + \(H_2\) ---> Cu + \(H_2O\) (Lập và cân bằng phương trình)
0,2 mol 0,2 mol 0,2 mol 0,2 mol
a. + Số mol của CuO:
\(n_{CuO}\) = \(\dfrac{m}{M}\) = \(\dfrac{16}{80}\) = 0,2 (mol)
+ Thể tích của \(H_2\)
\(V_{H_2}\) = n . 22,4 = 0,2 . 22,4 = 4,48 (lít)
b. Khối lượng Cu sau phản ứng:
\(m_{Cu}\) = n . M = 0,2 . 64 = 12,8 (g)
______________________________
Bài 5 nha, sai thì nhắn mình :))

2KClO3-to\xt->2KCl+3O2
0,1------------------0,1
n KClO3=\(\dfrac{12,25}{122,5}\)=0,1 mol
=>m KCl=0,1.74,5=7,45g
H=\(\dfrac{6,8}{7,45}.100\)=91,275%
b)
2KClO3-to\xt->2KCl+3O2
0,2-------------------------0,3 mol
n O2=\(\dfrac{6,72}{22,4}\)=0,3 mol
H=85%
=>m KClO3=0,2.122,5.\(\dfrac{100}{85}\)=28,82g
c)
2KClO3-to\xt->2KCl+3O2
0,2------------------------0,3
n KClO3=\(\dfrac{24,5}{122,5}\)=0,2 mol
H=80%
=>m O2=0,3.32.\(\dfrac{80}{100}\)=10,4g

a, Ta có: \(n_{Fe_3O_4}=\dfrac{11,6}{232}=0,05\left(mol\right)\)
PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
___0,15__0,1____0,05 (mol)
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
\(V_{O_2}=0,1.22,4=2,24\left(l\right)\)
b, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
________0,2________________________0,1 (mol)
\(\Rightarrow m_{KMnO_4}=0,2.158=31,6\left(g\right)\)
Bạn tham khảo nhé!



Câu 6.
\(n_{O_2}=\dfrac{16,8}{22,4}=0,75mol\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
1,5 0,75
\(m_{KMnO_4}=1,5\cdot158=237g\)
Câu 7.
\(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02mol\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,04 0,02
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(\dfrac{2}{75}\) 0,04
\(m_{KClO_3}=\dfrac{2}{75}\cdot122,5=\dfrac{49}{15}\approx3,27g\)
Bài 6 :
\(n_{O_2}=\dfrac{16.8}{22,4}=0,75\left(mol\right)\)
PTHH : 2KMnO4 ----t0-----> K2MnO4 + MnO2 + O2
1,5 0,75
\(m_{KMnO_4}=1,5.158=237\left(g\right)\)