A là hh khí gồm CH4 , C2H4 và H2. Cho 3360 ml A sục qua dd brom thấy dd bị nhạt màu và khối lượng tăng thêm 0,84 g.
a. Xác định % thể tích mỗi khí trong A. Biết rằng 0,7 lit hh khí này có khối lượng 0,4875g.
b. Đốt cháy hoàn toàn 1,68 lít A rồi dẫn sản phẩm vào 1 lít dd Ca(OH) 2 0,05M ( D= 1,025). Tính nồng độ % của chất sau phản ứng. Các thể tích khí đo ở đktc.

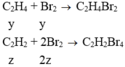
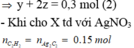

a) \(m_{tăng}=m_{C_2H_4}=0,84\left(g\right)\)
=> \(n_{C_2H_4}=\dfrac{0,84}{28}=0,03\left(mol\right)\)
Gọi số mol CH4, H2 trong 3360 ml A là a, b
=> \(a+b=\dfrac{3,36}{22,4}-0,03=0,12\left(mol\right)\) (1)
Gọi số mol CH4, H2 trong 0,7 lít hh là ak, bk
=> ak + bk + 0,03k = \(\dfrac{0,7}{22,4}=0,03125\) (2)
Và 16ak + 2bk + 0,84k = 0,4875 (3)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=0,09\left(mol\right)\\b=0,03\left(mol\right)\\k=\dfrac{5}{24}\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,03}{0,15}.100\%=20\%\\\%V_{CH_4}=\dfrac{0,09}{0,15}.100\%=60\%\\\%V_{H_2}=\dfrac{0,03}{0,15}.100\%=20\%\end{matrix}\right.\)
b)
\(n_{C_2H_4}=\dfrac{1,68}{22,4}.20\%=0,015\left(mol\right)\)
\(n_{CH_4}=\dfrac{1,68}{22,4}.60\%=0,045\left(mol\right)\)
\(n_{H_2}=\dfrac{1,68}{22,4}.20\%=0,015\left(mol\right)\)
Bảo toàn C: \(n_{CO_2}=0,075\left(mol\right)\)
Bảo toàn H: \(n_{H_2O}=0,135\left(mol\right)\)
\(n_{Ca\left(OH\right)_2}=0,05.1=0,05\left(mol\right)\)
\(m_{ddCa\left(OH\right)_2}=1000.1,025=1025\left(g\right)\)
PTHH: Ca(OH)2 + CO2 --> CaCO3 + H2O
0,05---->0,05----->0,05
CaCO3 + CO2 + H2O --> Ca(HCO3)2
0,025<--0,025------------>0,025
\(m_{CaCO_3}=\left(0,05-0,025\right).100=2,5\left(g\right)\)
mdd sau pư = 1025 + 0,075.44 + 0,135.18 - 2,5 = 1028,23 (g)
\(C\%_{Ca\left(HCO_3\right)_2}=\dfrac{0,025.162}{1028,23}.100\%=0,3939\%\)