Đốt cháy 5,4 gam aluminium thu được aluminium oxide
a) Tính khối lượng aluminium oxide thu được
b) Tính thể tích khí oxygen cần dùng (đkc)
c) Tính khối lượng thuốc tím cần để điều chế khí oxygen cho phản ứng trên ( Al=27, O=16, K=39, Mn=55 )
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

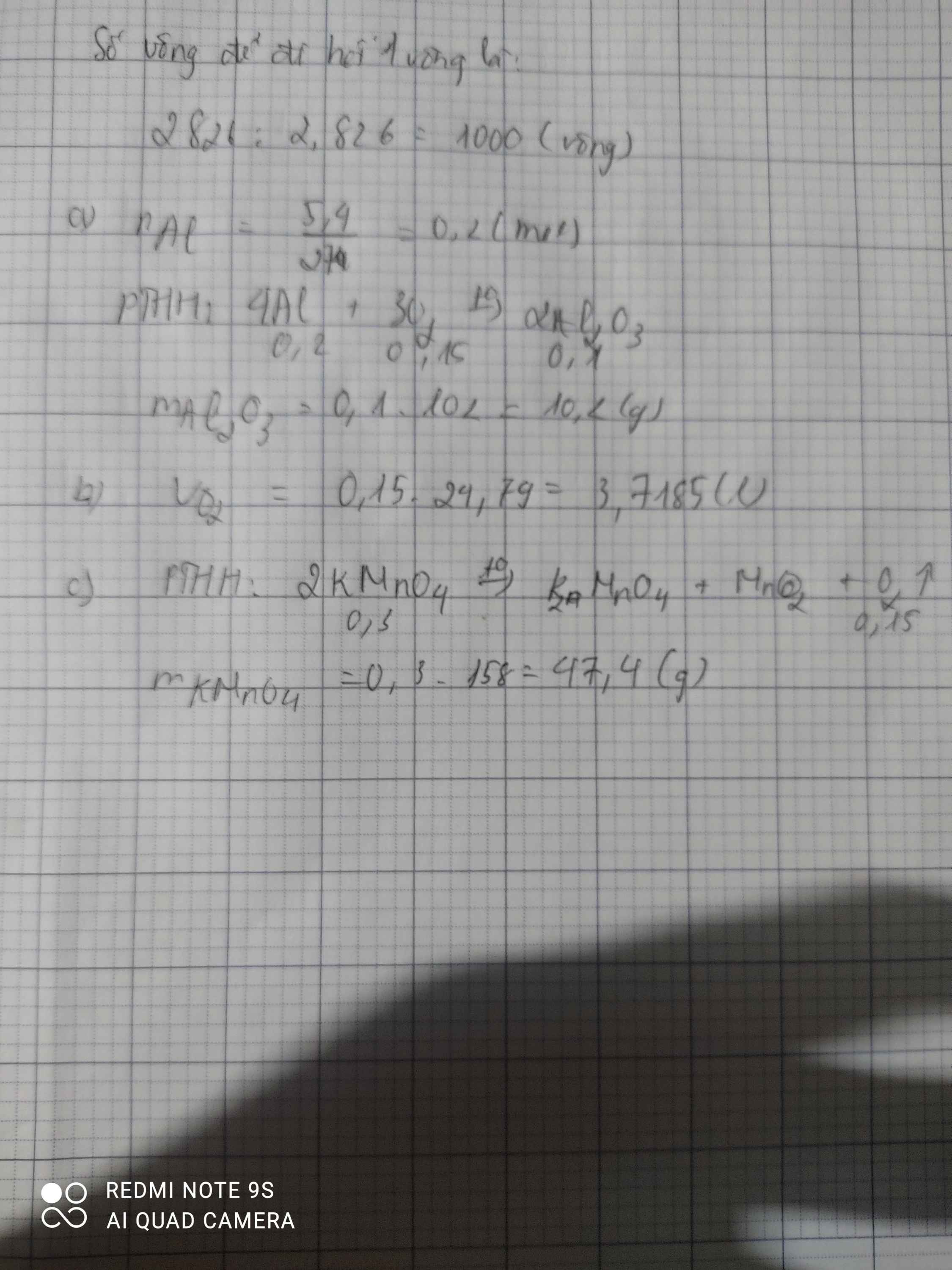

\(a,PTHH:4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ b,n_{Al_2O_3}=\dfrac{30,6}{102}=0,3\left(mol\right)\\ n_{Al}=\dfrac{4}{2}.n_{Al_2O_3}=2.0,3=0,6\left(mol\right)\\ \Rightarrow m_{Al}=0,6.27=16,2\left(g\right)\\ c,n_{O_2}=\dfrac{3}{2}.n_{Al_2O_3}=\dfrac{3}{2}.0,3=0,45\left(mol\right)\\ \Rightarrow V_{O_2\left(đkc\right)}=0,45.24,79=11,1555\left(l\right)\)
a, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, \(nAl_2O_3=\dfrac{30,6}{102}=0,3\left(mol\right)\)
\(nAl=\dfrac{4}{2}.0,3=0,6\left(mol\right)\)
\(mAl=0,6.27=16,2\left(g\right)\)
c, \(nO_2=\dfrac{3}{2}.0,3=0,45\left(mol\right)\)
\(VO_{2\left(đkc\right)}=0,45.24,79=11,1555\left(l\right)\)

1. \(n_{O_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Theo PT: \(n_{Al}=\dfrac{4}{3}n_{O_2}=\dfrac{2}{15}\left(mol\right)\Rightarrow m_{Al}=\dfrac{2}{15}.27=3,6\left(g\right)\)
2. \(n_{KCl\left(25\%\right)}=300.25\%=75\left(g\right)\)
Gọi: m dd KCl 10% = a (g) ⇒ mKCl (10%) = 10%a (g)
\(\Rightarrow\dfrac{75+10\%a}{a+300}=0,15\Rightarrow a=600\left(g\right)\)

\(n_{Al}=\dfrac{0,54}{27}=0,02\left(mol\right)\)
Pt : \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
0,02-->0,015-->0,01
a) \(m_{Al2O3}=0,01.102=1,02\left(g\right)\)
b) \(V_{O2\left(dktc\right)}=0,015.24,79=0,37185\left(l\right)\)
sửa lại \(V_{\left(dktc\right)}-->V_{\left(dkc\right)}\)

a) PTHH:
\(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
b) \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
Theo PTHH: \(n_{Al_2O_3}=\dfrac{0,1\cdot2}{4}=0,05\left(mol\right)\)
\(\Rightarrow m_{Al_2O_3}=0,05\cdot102=5,1\left(g\right)\)
c) Theo PTHH: \(n_{O_2}=\dfrac{0,1\cdot3}{4}=0,075\left(mol\right)\)
\(\Rightarrow V_{O_2\left(dktc\right)}=0,075\cdot22,4=0,168\left(l\right)\)

Phương trình hoá học: 4Al + 3O2 → 2Al2O3.
Số mol Al tham gia phản ứng:
n Al = mAl : M Al = 0,54 : 27 = 0,02 mol
a) Từ phương trình hóa học ta có:
n Al2O3 = ½ n Al = 0,02 : 2 = 0,01 mol
n Al2O3 = 0,01 x 102 = 10,2 gam
b) theo phương trình hóa học ta có:
n O2 = ¾ n Al = ¾ x 0,02 = 0,015 mol
V O2 (đkc) = 0,015 x 24,79 = 0,37185 (lít)
\(PTHH:4Al+3O_2\left(t^o\right)\rightarrow2Al_2O_3\\ n_{Al}=\dfrac{0,54}{27}=0,02\left(mol\right)\Rightarrow n_{Al}=\dfrac{2}{4}.0,02=0,01\left(mol\right);n_{O_2}=\dfrac{3}{4}.0,02=0,15\left(mol\right)\\ a,m_{Al_2O_3}=0,01.27=0,27\left(g\right)\\ b,V_{O_2\left(đkc\right)}=0,15.24,79=3,7185\left(l\right)\)

a) \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,2-->0,15
=> V = 0,15.22,4 = 3,36 (l)
b)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,3<----------------------------0,15
=> mKMnO4(lý thuyết) = 0,3.158 = 47,4 (g)
=> \(m_{KMnO_4\left(tt\right)}=\dfrac{47,4.110}{100}=52,14\left(g\right)\)

1.\(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,3 0,1 ( mol )
\(m_{Fe}=0,3.56=16,8g\)
2.\(n_{Cu}=\dfrac{3,2}{64}=0,05mol\)
\(2Cu+O_2\rightarrow\left(t^o\right)2CuO\)
0,05 0,05 ( mol )
\(m_{CuO}=0,05.80=4g\)
3.\(n_{Na}=\dfrac{4,6}{23}=0,2mol\)
\(4Na+O_2\rightarrow\left(t^o\right)2Na_2O\)
0,2 0,05 ( mol )
\(V_{O_2}=0,05.24,79=1,2395l\)
4.\(n_{Cu}=\dfrac{1,6}{64}=0,025mol\)
\(2Cu+O_2\rightarrow\left(t^o\right)2CuO\)
0,025 0,0125 ( mol )
\(V_{O_2}=0,0125.24,79=0,309875l\)