28. Hòa tan hoàn toàn 24 gam hh X gồm Fe2O3 và CuO (tỉ lệ mol Fe2O3 và CuO là 1:1) trong dd H2SO4 dư thu
được dd Y có H2SO4 (dư 25% so với lượng đã tham gia phản ứng) và m gam muối.
a) Tính tỉ lệ % khối lượng của các chất trong X và tính m.
b) Tính số gam H2SO4 có trong dung dịch axit ban đầu.
c) Cho dd Y tác dụng với dung dịch BaCl2 dư thu được a gam kết tủa. Tính a
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, Ta có: $n_{O}=0,6(mol)$
Suy ra $n_{H^+/pu}=1,2(mol)\Rightarrow n_{H_2SO_4}=0,6(mol)$
Bảo toàn khối lượng ta có: $m_{muoi}=29,6+0,6.96=87,2(g)$

\(PTHH:Zn+H_2SO_4\to ZnSO_4+H_2\\ CuO+H_2SO_4\to CuSO_4+H_2O\\ \Rightarrow n_{Zn}=n_{H_2}=\dfrac{4,48}{22,4}=0,2(mol)\\ \Rightarrow m_{Zn}=0,2.65=13(g)\\ \Rightarrow \%_{Zn}=\dfrac{13}{21}.100\%=61,9\%\\ \Rightarrow \%_{CuO}=100\%-61,9\%=38,1\%\\ \Rightarrow n_{CuO}=\dfrac{21-13}{80}=0,1(mol)\\ \Rightarrow \Sigma n_{H_2SO_4}=0,1+0,2=0,3(mol)\\ \Rightarrow V_{dd_{H_2SO_4}}=\dfrac{0,3}{0,5}=0,6(l)\)

\(n_{H2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
a) Pt : \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O|\)
1 1 1 1
0,1 0,1
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2|\)
1 1 1 1
0,2 0,2 0,2
b) \(n_{Zn}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(m_{Zn}=0,2.65=13\left(g\right)\)
\(m_{CuO}=21-13=8\left(g\right)\)
0/0CuO = \(\dfrac{8.100}{21}=38,1\)0/0
0/0Zn = \(\dfrac{13.100}{21}=61,9\)0/0
c) Có : \(m_{CuO}=8\left(g\right)\)
\(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
\(n_{H2SO4\left(tổng\right)}=0,1+0,2=0,3\left(mol\right)\)
\(V_{ddH2SO4}=\dfrac{0,3}{0,5}=0,6\left(l\right)\)
Chúc bạn học tốt

Fe3O4 + 8HCl --> FeCl2 + 2FeCl3 + 4H2O
_a_______8a______a_____2a______4a_
Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
_b______6b_______2b_____3b_
FeO + 2HCl --> FeCl2 + H2O
_c____2c_______c______c_
Fe + 2HCl --> FeCl2 + H2
_d___2d________d________d_
H2 + CuO --> Cu + H2O
_d____d_____d_____d_
nCuO = 3.2 / 80 = 0.04
=> d = 0.04
mHCl = 360 * 18.25 / 100 = 65.7 (g)
nHCl = 65.7 / 36.5 = 1.8 (mol)
=> 8a + 6b + 2c + 2d = 1.8
=> 8a + 6b + 2c + 0.08 = 1.8
=> 8a + 6b + 2c = 1.72
=> 4a + 3b + c = 0.86
a)
theo đlbtkl ta có
mHCl + mhh = mmuối + mH2O + mH2
65.7 + 57.6 = mmuối + 0.86 * 18 + 0.04 * 2
=> mmuối = 107.74 (g)
b) Fe3O4 + 8HCl --> FeCl2 + 2FeCl3 + 4H2O
_a_______8a______a_____2a______4a_
Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
_b______6b_______2b_____3b_
FeO + 2HCl --> FeCl2 + H2O
_b____2b_______b______b_
Fe + 2HCl --> FeCl2 + H2
0.2__0.4_______0.2____0.2
nH2 = nFe = 0.2
232a + 232b =57.6-0.2X56
8a + 8b = 1.8-0.2X2
vô nghiệm vì nFe2O3 =nFeO tuong đương 2ẩn cung M

Đáp án D
Gọi nCuO = nFe2O3 = x (mol)
=> 80x + 160y = 4,8
=> x = 0,02 (mol)
Vì CO dư và phản ứng xảy ra hoàn toàn nên chất rắn thu được sau phản ứng là Cu và Fe
=> m rắn = mCu + mFe = 0,02.64 + 0,02.2.56 = 3,52 (g)

\(Fe_2O_3 + 3H_2SO_4 ---> Fe_2(SO_4)_3 + 3H_2O\)
\(CuO + H_2SO_4 ---> CuSO_4 + H_2O\)
\(n_{H_2SO_4}= 0,25 . 1= 0,25 mol\)
\(Gọi n_{Fe_2O_3} và n_{CuO} là x, y\)
\(\begin{cases} 160x + 80y= 16\\ 3x + y= 0,25 \end{cases}\)
\(\Rightarrow \) \(\left[\begin{array}{} x=0,05\\ y=0,1 \end{array} \right. \)
C% Fe2O3= \(\dfrac{0,05 . 160}{16}= 50%\)
C% CuO= 50%
Pt : \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O|\)
1 6 1 3
a 6b
\(CuO+1H_2SO_4\rightarrow CuSO_4+H_2O|\)
1 1 1 1
a 2a
Gọi a là số mol của Fe2O3
b là số mol của CuO
\(m_{CuO}+m_{Fe2O3}=16\left(g\right)\)
⇒ \(n_{Fe2O3}.M_{Fe2O3}+n_{CuO}.M_{CuO}=16g\)
⇒ 160a + 80b = 16g (1)
Ta có : 250ml = 0,25l
\(n_{H2SO4}=1.0,25-0,25\left(mol\right)\)
⇒ 3a + 1b = 0,25 (2)
Từ (1),(2), ta có hệ phương trình :
160a + 80b = 16g
3a + 1b = 0,25
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,1\end{matrix}\right.\)
\(m_{Fe2O3}=0,05.160=8\left(g\right)\)
\(m_{CuO}=0,1.80=8\left(g\right)\)
0/0Fe2O3 = \(\dfrac{8.100}{16}=50\)0/0
0/0CuO = \(\dfrac{8.100}{16}=50\)0/0
Chúc bạn học tốt
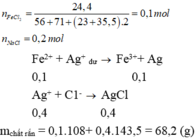
a) \(\left\{{}\begin{matrix}160n_{Fe_2O_3}+80n_{CuO}=24\\n_{Fe_2O_3}=n_{CuO}\end{matrix}\right.\Rightarrow n_{Fe_2O_3}=n_{CuO}=0,1\)
\(\left\{{}\begin{matrix}\%m_{Fe_2O_3}=\dfrac{160.0,1}{24}.100\%=66,67\%\\\%m_{CuO}=\dfrac{80.0,1}{24}.100\%=33,33\%\end{matrix}\right.\)
PTHH: Fe2O3 + 3H2SO4 --> Fe2(SO4)3 + 3H2O
0,1------>0,3-------->0,1
CuO + H2SO4 --> CuSO4 + H2O
0,1-->0,1---------->0,1
nCuSO4 = 0,1 (mol)
nFe2(SO4)3 = 0,1 (mol)
=> m = 0,1.160 + 0,1.400 = 56(g)
b) \(m_{H_2SO_4\left(pthh\right)}=\left(0,3+0,1\right).98=39,2\left(g\right)\)
=> mH2SO4(thực tế) = \(\dfrac{39,2.125}{100}=49\left(g\right)\)
c) \(n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\)
=> nBaSO4 = 0,5 (mol)
=> mBaSO4 = 0,5.233 = 116,5(g)