Hỗn hợp khí A gồm etan, etilen và axetilen. Dẫn 13,44 lít hỗn A qua lượng dư dung dịch brom thì có 6,72 lít khí thoát ra. Còn nếu cho cùng lượng hỗn hợp A trên qua lượng dư dung dịch AgNO3 trong NH3 thì thu được 24 gam kết tủa. Biết các thể tích khí được đo ở đktc. Hãy tính thành phần % theo khối lượng của mỗi chất có trong hỗn hợp khí A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

CH2=CH2 + Br2 → CH2Br-CH2Br
CH≡CH + Br2 → CHBr2-CHBr2
CH≡CH + 2AgNO3 + 2NH3 → AgC≡CAg↓vàng + 2NH4NO3
Khí không bị hấp thụ (hay không có phản ứng) là khí propan (C3H8)

a, \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Ta có: \(n_{Br_2}=\dfrac{16}{160}=0,1\left(mol\right)\)
Theo PT: \(n_{C_2H_4Br_2}=n_{Br_2}=0,1\left(mol\right)\Rightarrow m_{C_2H_4Br_2}=0,1.188=18,8\left(g\right)\)
b, Theo PT: \(n_{C_2H_4}=n_{Br_2}=0,1\left(mol\right)\Rightarrow n_{ankan}=\dfrac{6,72}{22,4}-0,1=0,2\left(mol\right)\)
Gọi CTPT của ankan là CnH2n+2.
PT: \(C_nH_{2n+2}+\dfrac{3n+1}{2}O_2\underrightarrow{t^o}nCO_2+\left(n+1\right)H_2O\)
\(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
Theo PT: \(n_{H_2O}=\left(n+1\right)n_{C_nH_{2n+2}}+2n_{C_2H_4}=\left(n+1\right).0,2+2.0,1=\dfrac{14,4}{18}\)
\(\Rightarrow n=2\)
Vậy: CTPT cần tìm là C2H6

$C_2H_2 + 2AgNO_3 + 2NH_3 \to Ag_2C_2 + 2NH_4NO_3$
Theo PTHH :
n C2H2 = n Ag2C2 = 48/240 = 0,2(mol)
$C_2H_4 + Br_2 \to C_2H_4Br_2$
$C_2H_2 + 2Br_2 \to C_2H_2Br_4$
n Br2 = 2n C2H2 + n C2H4 = 80/160 = 0,5(mol)
=> n C2H4 = 0,5 - 0,2.2 = 0,1(mol)
Vậy :
%V C2H2 = 0,2.22,4/8,96 .100% = 50%
%V C2H4 = 0,1.22,4/8,96 .100% = 25%
%V CH4 = 100% -50% - 25% = 25%

a, \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
b, - Khí thoát ra là CH4 ⇒ VCH4 = 6,72 (l)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{6,72}{13,44}.100\%=50\%\\\%V_{C_2H_2}=50\%\end{matrix}\right.\)
a. PTHH: \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
a. Vì CH4 không phản ứng với dd Br2 nên
\(V_{CH_4}=6,72\left(l\right)\)
\(\%V_{CH_4}=\dfrac{6,72}{13,44}x100\%=50\%\)
\(\%V_{C_2H_2}=100\%-50\%=50\%\)

Chọn D
C2H2 + AgNO3 -> Ag2C2↓
=> nkết tủa = nC2H2 =0,04 mol
,mbình tăng = mC2H2 + mC2H4 = 2,72g => nC2H4 = 0,06 mol
Đốt cháy : nCO2 = 2nC2H2 + 2nC2H4 = 0,2 mol
nOH = 0,15 mol < nCO2
=> phản ứng chỉ tạo HCO3 với số mol là 0,15 mol

nhh = 5.6/22.4 = 0.25(mol)
nAg2C2 = nC2H2 = 24/240 = 0.1 (mol)
nBr2 = 0.3 (mol)
=> nC2H4 = 0.3 - 0.1*2 = 0.1 (mol)
nCH4 = 0.25 - 0.1 - 0.1 = 0.05 (mol)
mCH4 = 0.05*16 = 0.8 (g)
mC2H2 = 0.1*26 = 2.6 (g)
mC2H4 = 0.1*28 = 2.8 (g)
mhh = 0.8 + 2.6 + 2.8 = 6.2 (g)
%CH4 = 0.8/6.2 * 100% = 12.9%
%C2H4 = 2.8/ 6.2 * 100% = 45.16%
%C2H2 = 41.94%

Khí thoát ra là CH4 => V CH4= 2,24(lít)
%V CH4 = 2,24/6,72 .100% = 33,33%
n C2H4 = a(mol) ; n C2H2 b(mol)
=> a + b = (6,72 - 2,24)/22,4 = 0,2(1)
m tăng = m C2H4 + m C2H2 = 28a + 26b = 5,4(2)
Từ (1)(2) suy ra a = b = 0,1
V C2H2 = V C2H4 = 0,1.22,4 = 2,24(lít)
Vậy :
%V C2H2 = %V C2H4 = (100%-33,33%)/2 = 33,335%
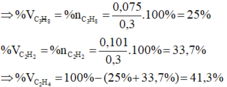
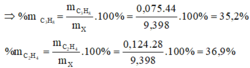
\(V_{C_2H_6}=13,44-6,72=6,72\left(l\right)\)
=> \(n_{C_2H_6}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{C_2Ag_2}=\dfrac{24}{240}=0,1\left(mol\right)\)
=> \(n_{C_2H_2}=0,1\left(mol\right)\)
=> \(n_{C_2H_4}=\dfrac{13,44}{22,4}-0,3-0,1=0,2\left(mol\right)\)
=> \(\left\{{}\begin{matrix}\%m_{C_2H_6}=\dfrac{0,3.30}{0,3.30+0,2.28+0,1.26}.100\%=52,326\%\\\%m_{C_2H_4}=\dfrac{0,2.28}{0,3.30+0,2.28+0,1.26}.100\%=32,558\%\\\%m_{C_2H_2}=\dfrac{0,1.26}{0,3.30+0,2.28+0,1.26}.100\%=15,116\%\end{matrix}\right.\)