Cho hợp chất oxit của sắt FexOy; Hóa trị của Fe trong công thức hóa học trên là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Coi oxit sắt gồm hai nguyên tố Fe,O
Bản chất là O trong oxit tác dụng với H trong axit để tạo nước.
\(2H + O \to H_2O\)
\(n_H = n_{HCl} = \dfrac{4,38}{36,5} = 0,12(mol)\)
Theo PTHH :
\(n_O = \dfrac{1}{2}n_H = 0,06(mol)\)
\(\Rightarrow n_{Fe} = \dfrac{3,2-0,06.16}{56} = 0,04(mol)\)
Ta có :
\(\dfrac{n_{Fe}}{n_O} = \dfrac{0,04}{0,06} = \dfrac{2}{3}\)
Vậy oxit sắt cần tìm : \(Fe_2O_3\)

1)yH2 + FexOy --> xFe + yH2On
H2 = 8,96/22,4 = 0,4 (mol)
nH2O = 7,2/18 = 0,4 (mol)
=> H2 đã phản ứng hết hay FexOy dư
mH2 = 2.0,4 = 0,8 (g)
Ta có m = mA + mH2O - mH2 = 28,4 + 7,2 - 0,8 = 34,8 (g)
2)Trong A chứa 59,155% Fe=
> mFe = 59,155%.28,4 = 16,8 (g)
=> nFe = 16,8/56 = 0,3 mol
Từ pt pư ta cóx/y = nFe/nH2 = 0,3/0,4 = 3/4=> Oxit sắt đã dùng là Fe3O4

\(n_{Fe_xO_y}=\dfrac{32}{56x+16y}\left(mol\right)\)
PTHH: FexOy + yH2 --to--> xFe + yH2O
\(\dfrac{32}{56x+16y}\)----------->\(\dfrac{32x}{56x+16y}\)
=> \(\dfrac{32x}{56x+16y}=\dfrac{22,4}{56}=0,4\)
=> \(\dfrac{x}{y}=\dfrac{2}{3}\)
=> CTHH: Fe2O3
\(n_{Fe}=\dfrac{22,4}{56}=0,4mol\)
\(Fe_xO_y+yH_2\rightarrow xFe+yH_2O\)
\(\dfrac{0,4}{x}\) 0,4
\(\Rightarrow M=\dfrac{32}{\dfrac{0,4}{x}}=80x\)
Mà \(M_{Fe_xO_y}=56x+16y=80x\Rightarrow16y=24x\Rightarrow\dfrac{x}{y}=\dfrac{16}{24}=\dfrac{2}{3}\)
\(\Rightarrow\left\{{}\begin{matrix}x=2\\y=3\end{matrix}\right.\Rightarrow Fe_2O_3\)

\(n_{H_2}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(BTKL:\)
\(m+0.4\cdot2=28.4+7.2\)
\(\Rightarrow m=34.8\left(g\right)\)
\(b.\)
\(m_{Fe}=0.59155\cdot28.4=16.8\left(g\right)\)
\(n_{Fe}=\dfrac{16.8}{56}=0.3\left(mol\right)\)
\(PTHH:\)
\(\dfrac{x}{y}=\dfrac{n_{Fe}}{n_{H_2}}=\dfrac{0.3}{0.4}=\dfrac{3}{4}\)
\(CT:Fe_3O_4\)

Gọi số mol của FexOy là a, suy ra CuO là 2a.
\(2Fe_xO_y+yC\rightarrow2xFe+yCO_2\)
\(2CuO+C\rightarrow2Cu+CO_2\)
\(\Rightarrow n_{Fe}=xn_{FexOy}=ax,n_{Cu}=n_{CuO}=2a\)
\(\Rightarrow56.ax+64.2a=3\)
\(\Rightarrow n_{CO2}=0,5yn_{FexOy}+\frac{1}{2}n_{CuO}=0,5ay+a=\frac{0,7}{22,4}=0,03125\)
\(\Rightarrow\frac{a\left(56+128\right)}{a\left(0,5y+1\right)}=\frac{3}{0,03125}=96\)
\(56x+128=48y+96\Rightarrow56x+32=48y\)
\(\Rightarrow6y-7x=4\)
Chỉ thỏa mãn cặp nghiệm x=2; y=3.
Vậy oxit là Fe2O3

nH2= 0,448/22,4= 0,02(mol)
PTHH :
CuO + H2 -tdo--> Cu + H20
FexOy + yH2 -tdo-> xFe + yH20
Cu + HCl --> k pu
Fe + 2HCl ---> FeCl2 + H2
0,02 -- 0,04---> 0,02 --- 0,02 (mol)
mFe = 0,02 .56= 1,12(g)
=> mCu = 1,76 - 1,12= 0,64(g)
n Cu = 0,64 /64 =0,01(mol)
PTHH :
CuO + H2 -tdo-> Cu + H20
0,,01 --0,01 ----> 0,01(mol)
mCuO= 0,01 . 80 = 0,8(g)
=> mFexOy = 2,4-0,8= 1,6(g)
PTHH :
FexOy + yH2 ---> xFe + yH20
56x+ 16y ---------> 56x
1,6 (g) -------------> 1,12(g)
<=> 1,6 .56x = 1,12( 56x + 16y)
<=> 89,6x = 62,72 x + 17,92y
<=> 89,6x - 62,72x = 17,92y
<=> 26,88 x = 17,92y
=> x/y= 17,92 / 26,88 =2/3
Vậy công thức đúng là Fe203.

a)
nH2 = 8.96/22.4 = 0.4 (mol) => mH2 = 0.4x2 = 0.8 (g)
yH2 + FexOy --to--> xFe + yH2O
theo đlbtkl ta có:
mH2 + mFexOybanđầu = mFe + mFexOydư + mH2O
<=> 0.8 + m = 28.4 + 7.2
=> m = 34.8 (g)
b)
mFe = 28,4x59,155% = 16.8 (g) => nFe = 16.8/56 = 0.3 (mol)
yH2 + FexOy --to--> xFe + yH2O
0.4______________0.3
=> x : y = 0.3 : 0.4 = 3 : 4 => Fe3O4
a) \(n_{H_2\left(đầu\right)}=\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
\(n_{H_2O}=\dfrac{2,4.10^{23}}{6.10^{23}}=0,4\left(mol\right)\)
Bảo toàn H2:
\(n_{H_2phảnứng}=n_{H_2O}=0,4mol\)
Áp dụng định luật bảo toàn khối lượng ta có:
m = 0,4.18 + 28,4 - 0,4.2 = 34,8 (g)
b) yH2 + FexOy \(\underrightarrow{t^o}\) xFe + yH2O
\(m_{Fe_xO_y\left(X\right)}=28,4.\left(100\%-59,155\%\right)=11,6\left(g\right)\)
\(m_{Fe_xO_yphảnứng}=31,8-11,6=23,2\left(g\right)\)
\(n_{Fe\left(X\right)}=n_{Fe\left(Fe_xO_yphảnứng\right)}=\dfrac{28,4.59,155\%}{56}=0,3\left(mol\right)\)
\(n_O=n_{H_2O}=0,4mol\)
x : y = 0,3 : 0,4 = 3 : 4
⇒ CT: Fe3O4

Các oxit sắt, nung ngoài không khí đến khối lượng không đổi luôn tạo thành Fe2O3 16 gam oxit sắt duy nhất là Fe2O3.
Cách 1: Phương pháp đại số
Đặt số mol các chất trong 18,56 gam A F e C O 3 : n ; F e x O y : m
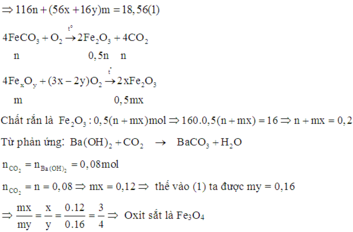
Cách 2: Phương pháp bảo toàn
Đặt số mol các chất trong 18,56 gam A F e C O 3 : n ; F e x O y : m
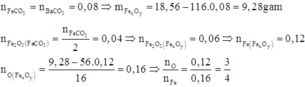
Cách 3: Bảo toàn nguyên tử C và O:
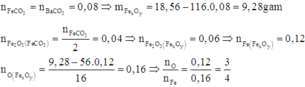
⇒ Oxit của sắt là Fe3O4
Cách 4: Bảo toàn nguyên tử và khối lượng:
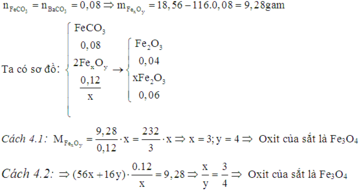
Đáp án B.


Gọi CTHH của oxit sắt là: \(\overset{\left(a\right)}{Fe_x}\overset{\left(II\right)}{O_y}\)
Ta có: \(a.x=II.y\)
\(\Leftrightarrow a=\dfrac{IIy}{x}=\dfrac{2y}{x}\)
Vậy hóa trị của Fe là 2y/x
2y/x