R có công thức oxit R2Oy trong đó oxi chiếm 56,34% khối lượng. biết phân tử khối của R2Oy là 142.Nguyên tử khối của R là :
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Hợp chất khí của R với hiđro có công thức phân tử là RH3.
Hợp chất oxit cao nhất của nguyên tố R là R2O5
Ta có \(\%O=\dfrac{16.5}{2R+16.5}.100=56,34\\ \Rightarrow R=31\left(Photpho-P\right)\\ \Rightarrow Z_R=SốE=15\)

Vì nguyên tố R tạo với hidro hợp chất khí có công thức RH3
=> Oxit cao nhất của R là R2O5
Lại có trong R2O5, oxi chiếm 56,34% về khối lượng
=> \(\frac{16\times5}{2R+16\times5}\times100\%=56.34\%\)
=> R = 31
=> R là Photpho

Chọn A
Công thức oxit ứng với hóa trị cao nhất của R là R 2 O 5
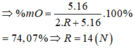
Dạ cho em hỏi là 74,07 phần trăm suy ra như thế nào vậy ạ? Em cảm ơn.

HD:
CT oxit cao nhất của R với oxi là R2O5 (suy ra từ RH3).
Ta có: 80/(2R+80) = 0,5634 suy ra: R = 14 (N).
cấu tạo:
Hóa trị cao nhất vs khí H là 3
>> hóa trị cao nhất vs O là 8_3=5
>>hợp chất vs oxit cao nhất là R2O5
Có %mO=56.34%
Xét tỉ số MO/Mo+MR =%mo
Hay80/80+2×MR=0.5634
>>MR=14(N)
>>hợp chất vs oxit cao nhất là N2O5
b) hợp chất vs H là NH3

Đáp án : B
Qui tắc bát tử : Do số hóa trị trong hợp chất với H là 3
=> Số hóa trị trong hợp chất oxit cao nhất là 8 – 3 = 5
=> R2O5 => %mO(oxit) = 5 . 16 2 R + 5 . 16 . 100 % = 74 , 07 %
=> R = 14 (N)
=> B

Có \(\dfrac{16y}{PTK_{R_2O_y}}.100\%=56,34\%=>\dfrac{16y}{142}.100\%=56,34\%\)
=> \(y=5\)
=> 2.NTKR + 16.5 = 142
=> NTKR = 31 (đvC)
Mình cám ơn bạn rất nhiều thankyou