Sử dụng dữ kiện sau cho câu số 3, 4
Cho khí H2 tác dụng với Fe2O3 đun nóng thu được 11,2 gam Fe
Câu 3. Khối lượng Fe2O3 đã tham gia phản ứng là:
A. 12 gam. B.13 gam. C.15 gam. D.16 gam.
Câu 4. Thể tích khí H2 (đktc) đã tham gia phản ứng là:
A. 1,12 lít. B. 2,24 lít. C. 6,72 lít. D. 4,48 lít.
Câu 5. Nếu cho 26 gam kẽm tác dụng hết với axit clohiđric thì thể tích khí H2 thu được ở điều kiện
tiêu chuẩn là:
A. 8,96 lít. B. 6,73 lít. C. 5,60 lít. D. 4,48 lít.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Fe2O3+3H2-to>2Fe+3H2O
0,1-------0,3------0,2-----0,3
n Fe=0,2 mol
=>m Fe2O3=0,1.160=16g =>D
VH2=0,3.22,4=6,72l =>C
3 D
4C
Sử dụng dữ kiện sau cho câu số 3,4
Cho khí H2 tác dụng với Fe2O3 đun nóng thu được 11,2g Fe
Câu 3: Khối lượng Fe2O3 đã tham gia phản ứng là:
A. 12g B.13g C.15g D.16g
Câu 4: Thể tích khí H2(đktc) đã tham gia phản ứng là:
A. 1,12lít B. 2,24 lít C. 6,72 lít D. 4,48 lít

câu 5:
Số mol của 122,5 g KClO3:
\(n_{KClO_3}=\dfrac{m}{M}=\dfrac{122,5}{122,5}=1\left(mol\right)\)
PTHH: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\uparrow\)
Tỉ lệ: 2 : 2 : 3
1 -> 1 : 1,5 (mol)
Thể tích của 1,5 mol \(O_2\) :
\(V_{O_2}=n.22,4=1,5.22,4=33,6\left(l\right)\)
Câu 6:
Số mol của 11,2 g Fe:
\(n_{Fe}=\dfrac{m}{M}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH: \(3H_2+Fe_2O_3\underrightarrow{t^o}3H_2O+2Fe\)
tỉ lệ 3 : 1 : 3 : 2
0,3 : 0,1 : 0,3 <-0,2 (mol)
a) khối lượng của 0,1 mol Fe2O3:
\(m_{Fe_2O_3}=n.M=0,1.160=16\left(g\right)\)
b) thể tích của 0,3 mol H2:
\(V_{H_2}=n.22,4=0,3.22,4=6,72\left(l\right)\)

\(n_{Fe}=\dfrac{28}{56}=0,5mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,5 1 0,5
\(V_{H_2}=0,5\cdot22,4=11,2l\)
\(m_{HCl}=1\cdot36,5=36,5g\)
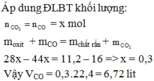
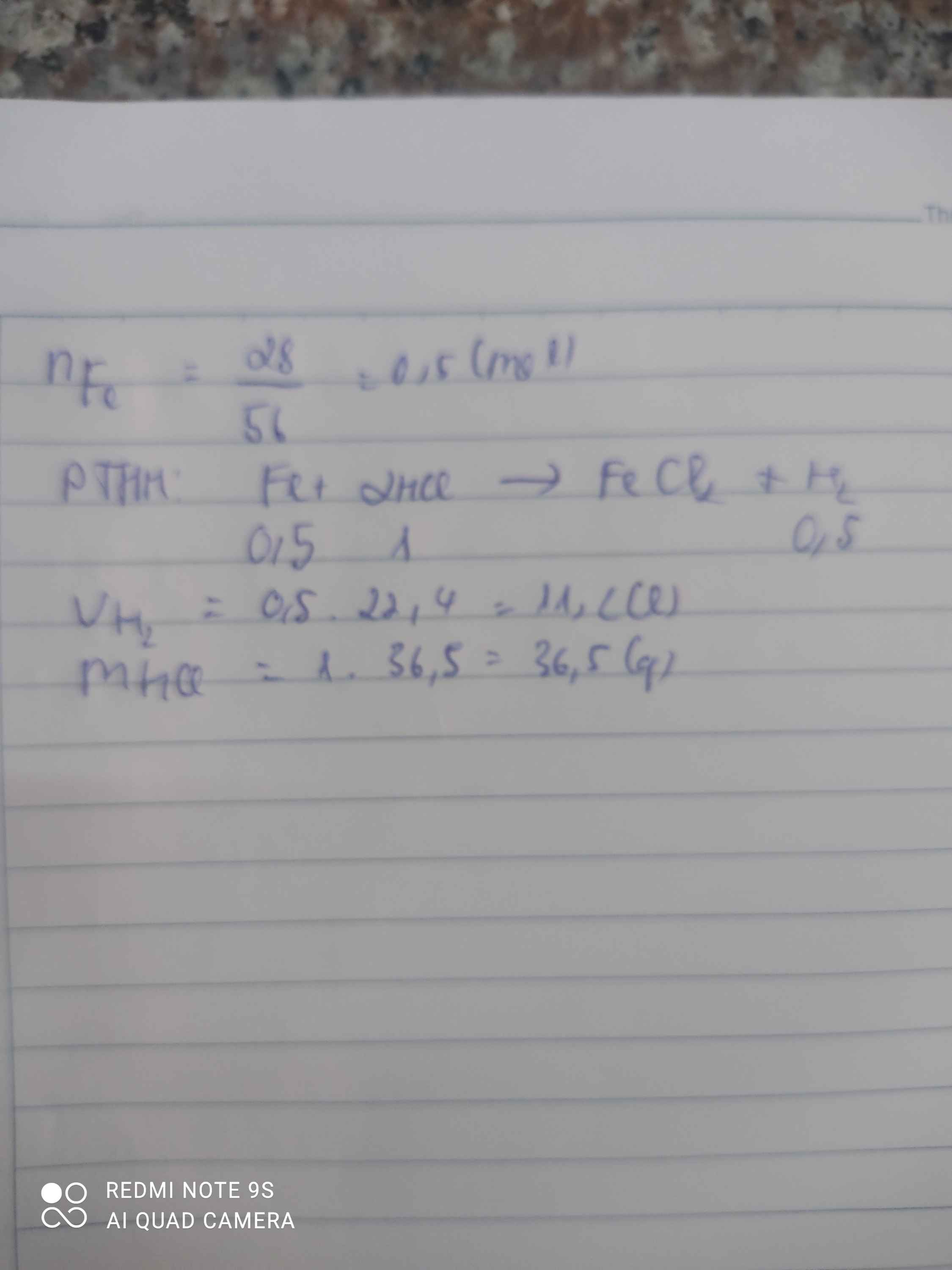
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,1<----0,3<----------0,2
Câu 3: D
mFe2O3 = 0,1.160 = 16(g)
Câu 4: C
VH2 = 0,3.22,4 = 6,72(l)
Câu 5: A
\(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
_____0,4----------------------->0,4
=> VH2 = 0,4.22,4 = 8,96 (l)