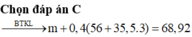ần lấy bao nhiêu gam dung dịch Fe(NO3)2 40% vào bao nhiêu ml nước cất để pha thành 500g dung dịch Fe(NO3)2 10%. Biết Dnước = 1g/ml.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


`m_(Fe(NO_3)_2) = 20% . 500 = 100` `(gam)` Khối lượng dung dịch `Fe(NO_3)_2` `90%` = `100/(90%) = 111,1` `(gam)` `⇔ m_(H_2O) = 500 – 111,1 = 388,9` `(gam)`

Bài 1
n\(_{HCl0,5M}=5.0,5=2,5\left(mol\right)\)
m HCl=2,5.36,5=91,25(g)
m\(_{ddHCl}=\frac{91,25.100}{36}=253,75\left(g\right)\)
V HCl cần lấy : \(\frac{253,75}{1,19}\approx213\left(ml\right)\)
2.
Ta có : m dung dịch sau khi pha=900.1,2=1080 gam
Gọi thể tích dung dịch HCl ban đầu là a; nước cất cần thêm là b
\(\rightarrow\) a+b=900; a.1,6+b.1=1080
Giải được: a=300; b=600 \(\rightarrow\)cần thêm 600 gam nước
3)
Ta có: nHCl=V.a mol
Thể tích dung dịch sau khi pha=x+V lít
\(\rightarrow\) CM HCl mới=\(\frac{nHCL}{V}\) dung dịch mới trộn=Va/(x+V)=b
\(\rightarrow\)Va=(x+V)b
\(\rightarrow\)Va=xb+Vb
\(\rightarrow\)Va-Vb=xb\(\rightarrow\)V(a-b)=xb\(\rightarrow\) x=\(\frac{V\left(a-b\right)}{b}\)
4)Ta có: nH2SO4=0,5.1=0,5 mol \(\rightarrow\) mH2SO4=0,5.98=49 gam
\(\rightarrow\)m dung dịch H2SO4 ban đầu=\(\frac{49}{98\%}\)=50 gam
\(\rightarrow\)V dung dịch H2SO4 =\(\frac{50}{1,84}\)=27,17 ml
\(\rightarrow\)V H2O cần thêm=500-27,17=472,83 ml
Cách pha; cho 27,17 ml dung dịch H2SO4 98% vào bình, sau đó cho thêm 472,83 ml H2O
5) Ta có: nFe(NO3)3=0,5.1=0,5 mol=nFe(NO3)3.6H2O
\(\rightarrow\) mFe(NO3)3.6H2O=0,5.(56+14.3+16.9+6.18)=175 gam

\(Đặt:V_{ddNaOH}=a\left(ml\right);V_{H_2O}=b\left(ml\right)\\\Rightarrow\left\{{}\begin{matrix}a+b=900\\a+1,2b=900.1,1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=450\left(ml\right)\\b=450\left(ml\right)\end{matrix}\right.\)
Vậy cần pha 450 ml dung dịch NaOH (D=1,2g/ml) với 450 ml H2O để tạo ra 900ml dung dịch NaOH (D=1,1g/ml)

Bạn tham khảo tại đây nhé
http://hocdethi.blogspot.com/2014/01/tuyen-tap-bai-tap-hoa-hoc-10.html

Đáp án B
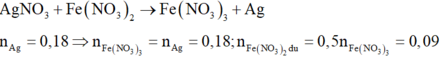
Gọi số mol Al và Mg tối đa mà dung dịch X có thể phản ứng được là x và 3x
Nên 3x + 2.3x = 0,09.2 + 0,18.3(ne cho =ne nhận)
Suy ra x = 0,08 => mAl + mMg = 7,92(g)

Đáp án D
Ta có phương trình phản ứng:
3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO + 2H2O
0.05 → 0 , 05 3 0,05 mol
Fe + NO3- + 4H+ → Fe3+ + NO + 2H2O
1 12 ← 0 , 1 - 0 , 05 3 → 1 12 mol
Fe + 2Fe3+ → 3 Fe2+
0 , 9 - 1 12 → 2 150
Trong dung dịch Y: n Fe 3 + = 0 , 05 + 1 12 - 2 150 = 0 , 12 mol
2Fe3+ + Cu → 2Fe2+ + Cu2+
0,12 => 0,06 mol
=> m Cu = 0 , 06 . 64 = 3 , 84 g

H2SO4 + nSO3 => H2SO4.nSO3
H2SO4.nSO3 + nH2O >> n+1H2SO4
H2SO4 + 2NaOH >> Na2SO4 + 2H2O
Số mol NaOH = 0,008 , số mol H2SO4 200ml = 0,008/2 . 200/10 =0,08
Theo (2) nH2SO4.nSO3 =0,08/n+1
MH2SO4.nSO3 =98 +80n = 6,76/0,08/n+1 =84,5n+ 84,5
13,5 =4,5n
=>n=3
%SO3=3.80/2.80+98 =71%
c,Theo câu b , hàm lượng % của SO3 có trong oleum trên là 71
Cứ 100g oleum có 71g SO3 và 29g H2SO4 Khi đó mdd = 1,31.100 = 131g
a g có 71a/100 ...............29a/100
Vì dd H2SO4 có C=40%
Cứ 100g dd có 40g H2SO4 và 60g H2O
=>131g >> 131.40/100 = 52,4g H2SO4 và 131.60/100 = 78,6 g H2O
Khi cho oleum vào dd H2SO4 thì SO3+H2O
SO3 + H2O >> H2SO4
Cứ 80g cần 18g >> 98g
Vậy ..x..g cần 78,6g >>..y..g
x= 78,6.80/18 = 349,3g
y= 78,6.98/18 = 427,9g
Trong loại oleum mới 10% thì mSO3 = 71a/100 -349,3g
và mH2SO4 = 29a/100 +52,4+ 427,9
=> 71a/100 -349,4 / 29a/100 +480,3 = 10/90
=> Bạn ấn máy tìm a nhé

Sửa đề: Fe(NO3)2 → Fe(NO3)3
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{Fe\left(NO_3\right)_3}=0,4.0,8=0,32\left(mol\right)\)
PT: \(Fe+2Fe\left(NO_3\right)_3\rightarrow3Fe\left(NO_3\right)_2\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,32}{2}\), ta được Fe dư.
Theo PT: \(n_{Fe\left(NO_3\right)_2}=\dfrac{3}{2}n_{Fe\left(NO_3\right)_3}=0,48\left(mol\right)\)
\(\Rightarrow m_{Fe\left(NO_3\right)_2}=0,48.180=86,4\left(g\right)\)