Cho 5,6 (g) sắt tác dụng với dung dịch H2SO4 đặc nóng, sắt tan hết. Khối lượng dung dịch sau phản ứng thay đổi như thế nào so với dung dịch H2SO4 lúc ban đầu? Biết sản phẩm tạo thành có khí SO2.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
_____0,2----------------------->0,2
Xét mZn -mH2 = 13-0,2.2=12,6(g)
=> khối lượng dd sau phản ứng tăng 12,6g
b)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
_____0,1--------------------------------->0,15
Xét mFe - mSO2 = 5,6 - 0,15.64 = -4
=> Khối lượng dung dịch sau phản ứng giảm đi 4g

Đáp án A
Số mol SO2 thu được là: n SO 2 = 5 , 6 22 , 4 = 0 , 25 mol
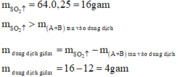

Thí nghiệm 1 :
\(n_{Mg} = a(mol) ; n_{Fe} = b(mol) \\ \Rightarrow 24a + 56b = 15,6(1)\\ Mg + H_2SO_4 \to MgSO_4 + H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{H_2} =a + b = 0,3(2)\\ (1)(2) \Rightarrow a = 0,0375 ; b = 0,2625\)
Thí nghiệm 2 : Vì khối lượng thí nghiệm 1 bằng 3 lần khối lượng thí nghiệm 2 nên ở thì nghiệm 2 : \(n_{Mg} = \dfrac{0,0375}{3}=0,0125(mol)\\ n_{Fe} = \dfrac{0,2625}{3} = 0,0875(mol)\\ \text{Bảo toàn electron : }\\ n_{SO_2} = \dfrac{0,0125.2 + 0,0875.3}{2} = 0,14375(mol)\\ m_X - m_{SO_2} = 5,2 - 0,14375.64 = -4\)
Vậy khối lượng dung dịch Z giảm 4 gam so với H2SO4 ban đầu.

Đáp án A
· Có n Al ( B ) = 2 3 . n H 2 = 2 3 . 0 , 672 22 , 4 = 0 , 02 mol
· Chất rắn thu được sau khi nung là Al2O3:
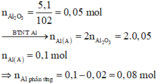
· Quy đổi A tương đương với hỗn hợp gồm 0,1 mol Al, a mol Fe, b mol O
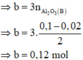
· Phần không tan D gồm Fe và oxit sắt + H2SO4 ® Dung dịch E + 0,12 mol SO2
Dung dịch E chứa một muối sắt duy nhất và không hòa tan được bột Cu
Þ Muối sắt là FeSO4.
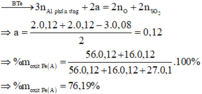

Sau phản ứng có Al dư do phản ứng với NaOH tạo H2
=> nAl dư = 2/3 .nH2 = 0,02 mol
Sau phản ứng có Al và Al2O3 + NaOH => NaAlO2
Bảo toàn Al ta có :
2nAl2O3 sau nung= nAl dư + 2nAl2O3 => nAl2O3 = 0,04 mol
=>nAl ban đầu = 0,1 mol
Do các phản ứng hàn toàn , mà khi nhiệt nhôm Al dư => oxit sắt hết
=>D chỉ có Fe
=>Bảo toàn e : 3nFe = 2nSO2 => nFe = 0,08 mol
Bảo toàn khối lượng : mA = mB = mFe + mAl + mAl2O3 = 9,1g
=>%mAl(A) = 29,67% gần nhất với giá trị 24%
=>A

Chọn C
H2SO4 loãng dư Þ nZn + nFe = 0,3 = nH2 (phản ứng hoàn toàn)
Þ Dm = 13 + 5,6 — 0,3.2 = +18 Þ Tăng 18 gam

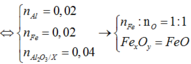
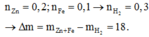
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
_____0,1---------------------------------->0,15
=> mSO2 = 0,15.64 = 9,6(g)
Do khối lượng SO2 tạo ra lớn hơn khối lượng Fe cho vào
=> Khối lượng dung dịch giảm so với ban đầu
Khối lượng sau phản ứng giảm: 9,6 - 5,6 = 4 (g)
\(Fe+H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)