Trộn 50 ml dung dịch NaOH 0,12M với 50 ml dung dịch H2SO40,1M. Tính nồngđộ mol của các ion trong dung dịch thu được và pH của dung dịch đó.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
nH+ = nHCl = 0,006
nOH- = nNaOH = 0,005
Khi pha trộn: H+ + OH- → H2O
=> nH+ dư = 0,001
=> [H+] = 0,001/0,1 = 0,01 => pH = 2

a) \(n_{H^+}=n_{HCl}+2n_{H_2SO_4}=0,1\cdot0,12+0,1\cdot0,04=0,016\)
\(C_M=\dfrac{0,016}{0,2}=0,08M\)
\(\Rightarrow pH=-log\left(0,08\right)=1,1\)
b) \(n_{OH^-}=n_{KOH}+2n_{Ba\left(OH\right)_2}=0,012+2\cdot0,004=0,02\)
\(C_M=\dfrac{0,02}{0,2}=0,1\)
\(\Rightarrow pH=-log\left(\dfrac{10^{-14}}{0,1}\right)=13\)

Chọn C
pH = 11 → [ OH - ] = 10 - 3 (M)
pH = 12 → [ OH - ] = 10 - 2 (M)
Tổng số mol OH - có trong dung dịch X là: n = 0 , 1 . 10 - 3 + 0 , 05 . 10 - 2 = 6 . 10 - 4 (mol)
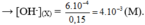

a, \(n_{HCl}=0,1.0,2=0,02\left(mol\right)=n_{H^+}=n_{Cl^-}\)
\(n_{H_2SO_4}=0,1.0,2=0,02\left(mol\right)=n_{SO_4^{2-}}\) \(\Rightarrow n_{H^+}=2n_{H_2SO_4}=0,04\left(mol\right)\)
\(n_{NaOH}=0,3.0,4=0,12\left(mol\right)=n_{Na^+}=n_{OH^-}\)
\(\Rightarrow\sum n_{H^+}=0,02+0,04=0,06\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,06__0,06 (mol)
⇒ nOH- dư = 0,12 - 0,06 = 0,06 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\left[Cl^-\right]=\dfrac{0,02}{0,1+0,3}=0,05\left(M\right)\\\left[SO_4^{2-}\right]=\dfrac{0,02}{0,1+0,3}=0,05\left(M\right)\\\left[Na^+\right]=\dfrac{0,12}{0,1+0,3}=0,3\left(M\right)\\\left[OH^-\right]=\dfrac{0,06}{0,1+0,3}=0,15\left(M\right)\end{matrix}\right.\)
b, pH = 14 - (-log[OH-]) ≃ 13,176

a, \(\left[Na^+\right]=0,1\)
\(\left[K^+\right]=0,1\)
\(\left[OH^-\right]=0,2\)
\(\left[SO_4^{2-}\right]=0,2\)
\(\left[H^+\right]=0,4\)
b, \(n_{H^+}=0,1.0,4=0,04\left(mol\right)\)
\(n_{OH^-}=0,1.0,2=0,02\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(\Rightarrow n_{H^+dư}=0,02\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,02}{200}=10^{-4}\)
\(\Rightarrow pH=4\)

$n_{NaOH} = n_{KOH} = 0,1.0,1 = 0,01(mol)$
$n_{H_2SO_4} = 0,02(mol)$
OH- + H+ → H2O
Bđ : 0,01...0,04..................(mol)
Pư : 0,01...0,01...................(mol)
Sau pư : 0......0,03...................(mol)
$V_{dd} = 0,1 + 0,1 = 0,2(lít)$
Vậy :
$[K^+] = [Na^+] = \dfrac{0,01}{0,2} = 0,05M$
$[H^+] = \dfrac{0,03}{0,2} = 0,15M$
$[SO_4^{2-}] = \dfrac{0,02}{0,2} = 0,1M$
b)
$pH = -log(0,15) = 0,824$
\(n_{NaOH}=0,006\left(mol\right)\\ \Rightarrow n_{Na^+}=0,006\left(mol\right);n_{OH^-}=0,006\left(mol\right)\\ n_{H_2SO_4}=0,005\left(mol\right)\\ \Rightarrow n_{H^+}=0,01\left(mol\right);n_{SO_4^{2-}}=0,005\left(mol\right)\\ H^++OH^-\rightarrow H_2O\\ LTL:\dfrac{0,01}{1}>\dfrac{0,006}{1}\Rightarrow H^+dư\\ \left[H^+_{dư}\right]=\dfrac{0,01-0,006}{0,1}=0,04M\\ \left[Na^+\right]=\dfrac{0,006}{0,1}=0,06M\\ \left[SO_4^{2-}\right]=\dfrac{0,005}{0,1}=0,05M\)