Hoà tan 14,2 gam điphotpho pentaoxit vào 180 gam nước.a) Tính khối lượng axit photphoric thu được.b) Tính nồng độ % của dung dịch axit photphoric.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
→ n P 2 O 6 = 0 , 2 → C % H 3 P O 4 = 98 . 0 , 2 . 2 + 500 . 0 , 098 500 + 28 , 4 . 100 % = 16 , 69 %

\(n_{P_2O_5}=\dfrac{28,4}{142}=0,2mol\)
\(n_{H_2O}=\dfrac{216}{18}=12mol\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
0,2 < 12 ( mol )
0,2 0,4 ( mol )
\(m_{H_3PO_4}=0,4.98=39,2g\)
Dung dịch sau phản ứng làm quỳ tím hóa xanh

nP2O5 = 0,015 mol
P2O5 + 3H2O \(\rightarrow\) 2H3PO4
\(\Rightarrow\) C% = \(\dfrac{0,03.98.100\%}{250}\) = 1,176%
nP2O5 = \(\dfrac{2,13}{142}\)=0,015 mol
P2O5 + 3H2O -> 2H3PO4
0,015 ->0,03
=>mH3PO4 = 0,03 . 98 = 2,94 g
C% = \(\dfrac{2,94}{2,13+250}\) .100% = 1,166%

mk chỉ hd kiểu này nha
n P2O5=0.2m ; nH3PO4= 0.5 m (500/98*9.8%)
hòa tan P2O5 vào nc có pư: P2O5 + 3 H2O ----> 2H3PO4
___> tổng n H3PO4 = 0.5+0.4= 0.9m ====>88.2g
có mdd sau pư = m p205 + m h3po4 = 28.4 + 88.2 = 116.6g
=> C% h3po4 = (tự giải tiếp nha lười nghĩ :)))))
1 like nha mn
à nhầm chỗ m dd sau pư nha
phải là 28.4+500= 528.4 g chứ :)))

\(1\\ 2Na + 2H_2O \to 2NaOH + H_2\\ n_{H_2} = \dfrac{1}{2}n_{Na} = \dfrac{1}{2}.\dfrac{4,6}{23} = 0,1(mol)\\ \Rightarrow V_{H_2} = 0,1.22,4 = 2,24(lít)\\ 2\\ P_2O_5 + 3H_2O \to 2H_3PO_4\\ n_{H_3PO_4} = 2.n_{P_2O_5} = 2.\dfrac{14,2}{142} = 0,2(mol)\\ \Rightarrow m_{H_3PO_4} = 0,2.98 = 19,6\ gam\)
Câu 1:
PTHH: \(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\uparrow\)
Ta có: \(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2}=0,1\left(mol\right)\\n_{NaOH}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,1\cdot22,4=2,24\left(l\right)\\m_{NaOH}=0,2\cdot40=8\left(g\right)\end{matrix}\right.\)
Câu 2:
PTHH: \(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
Ta có: \(n_{P_2O_5}=\dfrac{14,2}{142}=0,1\left(mol\right)\)
\(\Rightarrow n_{H_3PO_4}=0,2\left(mol\right)\) \(\Rightarrow m_{H_3PO_4}=0,2\cdot98=19,6\left(g\right)\)
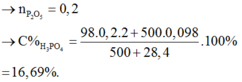

\(n_{P_2O_5}=\dfrac{14.2}{142}=0.1\left(mol\right)\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
\(0.1..........................0.2\)
\(m_{H_3PO_4}=0.2\cdot98=19.6\left(g\right)\)
\(m_{dd}=14.2+180=194.2\left(g\right)\)
\(C\%H_3PO_4=\dfrac{19.6}{194.2}\cdot100\%=10.09\%\)