Để đốt cháy hoàn toàn hỗn hợp Al và Mg cần 0,2 mol O2. Hỗn hợp kim loại trên tác dụng với dung dịch HCl dư thì thể tích H2(đktc) thu được?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\\n_{Fe}=c\left(mol\right)\end{matrix}\right.\)⇒ 24a + 27b + 56c = 26,05(1)
\(Mg + 2HCl \to MgCl_2 + H_2\\ 2Al +6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = a + 1,5b + c = \dfrac{13,44}{22,4} = 0,6(2)\)
\(Mg + Cl_2 \xrightarrow{t^o} MgCl_2\\ 2Al + 3Cl_2 \xrightarrow{t^o} 2AlCl_3\\ 2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3\\ n_{Cl_2} = a + 1,5b + 1,5c = \dfrac{17,36}{22,4} = 0,775(3)\)
Từ (1)(2)(3) suy ra: a = 0,325 ; b = -0,05 ; c = 0,35
→ Sai đề.

Chọn đáp án B
Gọi số mol mol mỗi kim loại là x mol
Khi cho X tác dụng HCl hình thành ZnCl2: x mol, CrCl2: x mol, SnCl2: x mol → 136x + 123x + 190x = 8,98 → x = 0,02 mol
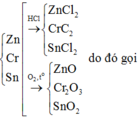
Khi cho X phản ứng với O2 hình thành ZnO, Cr2O3, SnO2
Bảo toàn electron ta có nO2 pứ = ![]() = 0,045 mol → V = 1,008 lít.
= 0,045 mol → V = 1,008 lít.
⇒ Chọn B

Đáp án D
Đặt Zn, Cr,Sn là x mol → ZnCl2 : x mol, SnCl2 : x mol và CrCl2 : x mol
→ x =0,02 mol
Bảo toàn O trong phương trình đốt cháy có 2nO2 = x + 2x + 3/2 x =0,09
→ VO2= 1,008 lít

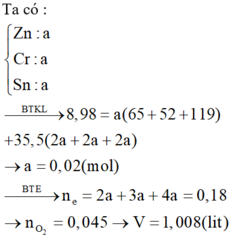
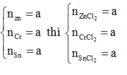






Gọi số mol Al, Mg là a,b (mol)
Có:
\(Al^0-3e->Al^{+3}\)
_a--->3a
\(Mg^0-2e->Mg^{+2}\)
_b---->2b
O20 +4e --> 2O-2
0,2->0,8
Theo ĐLBT e: 3a + 2b = 0,8 (1)
Có:
\(Al^0-3e->Al^{+3}\)
_a--->3a
Mg0 - 2e --> Mg+2
_b--->2b
2H+1 +2e --> H20
______2nH2<-nH2
Theo ĐLBT e: 3a + 2b = 2.nH2(2)
(1)(2) => 2nH2 = 0,8
=> nH2 = 0,4
=> VH2 = 0,4.22,4 = 8,96(l)