đốt cháy hoàn toàn một chất X thuộc hợp chất hữu cơ (chỉ chưa C và H) cần một thể tích oxi là 11,2 lít (ĐKTC). Chất khí sinh ra dẫn vào bình đựng nước vôi trong dư thì khối lượng bình này tăng thêm 13,2g. a) giải thích hiện tượng hóa học xảy ra. b) tìm công thưc phân tử của X, biết rằng tỉ khối của nó đối với oxi là 1,375. mong mọi người giúp mình !
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A

- Sau phản ứng cho thêm NaOH vẫn thấy tạo kết tủa chứng tỏ Ca OH 2 phản ứng hết, tạo muối CaCO 3 và Ca HCO 3 2 .
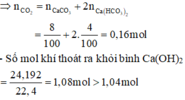
=> Chứng tỏ ngoài lượng N2 có trong không khí không bị hấp thụ bởi Ca OH 2 thì còn 1 lượng khí tạo thành từ phản ứng cháy cũng không không bị hấp thụ bởi Ca OH 2 .
=> Phản ứng cháy tạo thành khí CO 2 , hơi H 2 O và khí N 2 .
Số mol khí N2 sinh ra từ phản ứng cháy = 1,08 - 1,04 = 0,04 mol = n X
=> Chứng tỏ X chứa 2 nguyên tố N trong phân tử.

X mạch hở, có tổng 16 nguyên tử trong phân tử nên tổng số liên kết s = 15. (Nếu X mạch vòng thì tổng số liên kết s = 16).

\(n_{hh}=\dfrac{11,2}{22,4}=0,5mol\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=x\\n_{C_2H_4}=y\end{matrix}\right.\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
x x ( mol )
\(C_2H_4+3O_2\rightarrow\left(t^o\right)2CO_2+2H_2O\)
y 2y ( mol )
\(n_{CaCO_3}=\dfrac{80}{100}=0,8mol\)
\(Ca\left(OH\right)_2+CO_2\rightarrow\left(t^o\right)CaCO_3+H_2O\)
0,8 0,8 ( mol )
Ta có:
\(\left\{{}\begin{matrix}x+y=0,5\\x+2y=0,8\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,3\end{matrix}\right.\)
\(\%V_{CH_4}=\dfrac{0,2}{0,5}.100=40\%\)
\(\%V_{C_2H_4}=100\%-40\%=60\%\)
\(m_{tăng}=m_{Ca\left(OH\right)_2}+m_{CaCO_3}=0,8.\left(74+100\right)=139,2g\)

Đáp án C
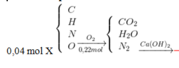
Ta có mBình tăng = mCO2 + mH2O = 13,3 gam.
Với nCO2 = nBaCO3 = 0,2 mol ||⇒ nH2O = 0,25 mol.
Nhận thấy nC ÷ nH = 0,2 ÷ (0,25×2) = 2 ÷ 5

Chọn đáp án C
Vì amin no đơn chức mạch hở ⇒ CTTQ là CnH2n+3N
Ta có: CnH2n+3N + 6 n + 3 4 O2 → (n + 1,5) H2O + nCO2 + 1 2 N2
⇒ nO2 × (n + 1,5) = nH2O × (6n + 3) ÷ 4
⇔ 0,375 × (n + 1,5) = 0,35 × (1,5n + 0,75)
⇔ n = 2 ⇒ Amin có ctpt là C2H7N
⇒ nCO2 = 0,2 ⇒ mCO2 = 8,8 gam.
+ Mà mBình ↑ = mCO2 + mH2O = 8,8 + 6,3 = 15,1 gam
⇒ Chọn C

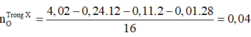


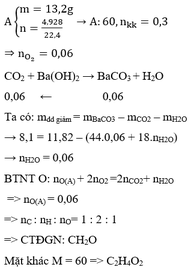
\(n_{O_2}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
\(Đặt:n_{CO_2}=a\left(mol\right),n_{H_2O}=b\left(mol\right)\)
\(m_{tăng}=m_{CO_2}+m_{H_2O}=13.2\left(g\right)\)
\(\Rightarrow44a+18b=13.2\left(1\right)\)
\(BảotoànO:\)
\(n_{CO_2}+\dfrac{1}{2}n_{H_2O}=n_{O_2}\)
\(\Rightarrow a+0.5b=0.5\left(2\right)\)
\(\left(1\right),\left(2\right):\)
\(a=-0.3,b=2.2\)
Em xem lại đề nhé.
sao ko làm câu a vậy