Một hỗn hợp khí gồm có 3,2 gam Oxi và 8,8gam khí cacsbon .Xác định khối lương trung bình của một mol hỗn hợp trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2}=\dfrac{12.10^{22}}{6.10^{23}}=0,2\left(mol\right)\); \(n_{N_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
=> mhh = 0,5.32 + 0,25.28 + 0,2.2 + 3,2 = 26,6(g)

Với 3 mol hỗn hợp khí có : 1.5 (mol) H2 , 0.5 (mol) N2 và 1 (mol) CO2
\(\overline{M}=\dfrac{1.5\cdot2+0.5\cdot28+1\cdot44}{3}=20.33\left(g\text{/}mol\right)\)

\(n_{H_2}=\dfrac{12.10^{22}}{6.10^{23}}=0,2\left(mol\right)\)
\(n_{SO_2}=\dfrac{3,2}{64}=0,05\left(mol\right)\)
=> Vhh = 0,25.22,4 + 4,48 + 0,2.22,4 + 0,05.22,4 = 15,68(l)

Khối lượng của các khí:
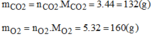
Thành phần phần trăm theo khối lượng:
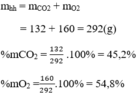
Thành phần phần trăm theo thể tích:
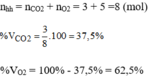

Khối lượng mol trung bình của hỗn hợp khí:
M = 18 x 2 = 36(g/mol)
Đặt x và y là số mol O 3 và O 2 có trong 1 mol hỗn hợp khí, ta có phương trình đại số :
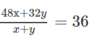
Giải phương trình, ta có y = 3x. Biết rằng tỉ lệ phần trăm về số mol khí cũng là tỉ lệ về thể tích : Thể tích khí oxi gấp 3 lần thể tích khí ozon. Thành phần của hỗn hợp khí là 25% ozon và 75% oxi.
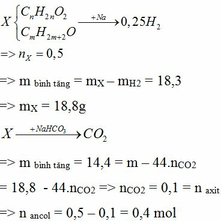

Hỗn hợp khí gồm 3,2 gam oxi và 8,8 gam cacbonic.
\(n_{O_2} = \dfrac{3,2}{32} = 0,1(mol)\\ n_{CO_2} = \dfrac{8,8}{44} = 0,2(mol)\\ \Rightarrow n_{hỗn\ hợp} = 0,1 + 0,2 = 0,3(mol)\\ \Rightarrow \overline{M_{hh}} = \dfrac{3,2 + 8,8}{0,3} = 40(g/mol)\)
nO2=3,2/32=0,1(mol)
nCO2=8,8/44=0,2(mol)
→M=3,2+8,8/0,1+0,2=40(g/mol)