Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

3Fe + 2O2 --to> Fe3O4 4Al + 3O2 -to-> 2Al2O3
x ---------------> x/3 y------------------> y/2
Theo đề bài\(\dfrac{\dfrac{x.232}{3}+\dfrac{y.102}{2}}{56x+27y}=\dfrac{283}{195}\)
Giải pt => x = 3y
=> %mFe =\(\dfrac{3y.56}{3y.56+27y}100=\) 86,15%
<=> %mAl = 100 - 86,15 = 13,85%

Đáp án A

Gọi số mol các chất trong A là Cl2 : a mol ; O2 : b mol
Sơ đồ phản ứng:

Tổ hợp (1) và (2) ta được : a = 0,25 mol ; b = 0,2 mol
Phần trăm khối lượng Cl2 trong A là:
![]()

Anh nghĩ nhôm oxit khối lượng 1,02 sẽ đúng hơn em ạ!

PTHH: \(2Mg+O_2\underrightarrow{t^o}2MgO\) (1)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\) (2)
Ta có: \(\left\{{}\begin{matrix}\Sigma n_{O_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\\n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\Rightarrow n_{O_2\left(2\right)}=0,075\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{O_2\left(1\right)}=1,425\left(mol\right)\) \(\Rightarrow n_{Mg}=2,85\left(mol\right)\)
\(\Rightarrow\%m_{Mg}=\dfrac{2,85\cdot24}{2,85\cdot24+2,7}\cdot100\%\approx96,2\%\)
\(\Rightarrow\%m_{Al}=3,8\%\)
\(n_{O_2} =\dfrac{33,6}{22,4} = 1,5(mol)\\ n_{Al} = \dfrac{2,7}{27} = 0,1(mol)\\ 2Mg + O_2 \xrightarrow{t^o} 2MgO\\ 4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3\\ n_{O_2} = \dfrac{1}{2}n_{Mg} + \dfrac{3}{4}n_{Al}\\ \Rightarrow n_{Mg} = 2,85(mol)\)
Vậy :
\(\%m_{Mg} = \dfrac{2,85.24}{2,85.24 + 2,7}.100\% = 96,2\%\\ \%m_{Al} = 100\% - 96,2\% = 3,8\%\)

a, \(2Cu+O_2\underrightarrow{t^o}2CuO\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, Theo ĐLBT KL, có: mX + mO2 = m oxit
⇒ mO2 = 18,2 - 11,8 = 6,4 (g)
c, Ta có: 64nCu + 27nAl = 11,8 (1)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{Cu}+\dfrac{3}{4}n_{Al}=\dfrac{6,4}{32}=0,2\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Cu}=0,1\left(mol\right)\\n_{Al}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{0,1.64}{11,8}.100\%\approx54,24\%\\\%m_{Al}\approx45,76\%\end{matrix}\right.\)

Đáp án A
Ta có sơ đồ phản ứng:
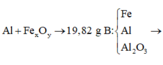
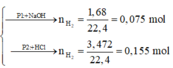
Phần 1:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
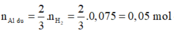
![]()
Phần 2:
2Al + 6HCl → 2AlCl3 + 3H2↑ (1)
0,05 → 0,075
Fe + 2HCl → FeCl2 + H2↑ (2)
![]()
![]()
![]()
![]()
Ta có phương trình phản ứng:
![]()
Khối lượng các chất trong 1 phần hỗn hợp B là 19,82/2 = 9,91 g
![]()
![]()
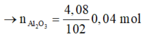
Ta có:
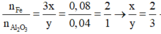
=> Oxit sắt cần tìm là Fe2O3

\(\left\{{}\begin{matrix}n_{Zn}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\Rightarrow65x+27y=2,87\left(1\right)\)
\(2Zn+O_2\underrightarrow{t^o}2ZnO\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(\Rightarrow81x+\dfrac{1}{2}y\cdot102=3,75\left(2\right)\)
Từ (1) và (2)\(\Rightarrow\left\{{}\begin{matrix}x=0,04\\y=0,01\end{matrix}\right.\)
\(\%m_{ZnO}=\dfrac{0,04\cdot81}{3,75}\cdot100\%=86,4\%\)
Hai oxit kim loại thu được là ZnO (a mol) và Al2O3 (b mol).
Ta có hệ phương trình:
\(\left\{{}\begin{matrix}65a+27.2b=2,87\\81a+102b=3,75\end{matrix}\right.\) \(\Rightarrow\) \(\left\{{}\begin{matrix}a=0,04\\b=0,005\end{matrix}\right.\).
Phần trăm khối lượng của kẽm oxit trong hỗn hợp sản phẩm là:
%mZnO=\(\dfrac{0,04.81}{3,75}.100\%=86,4\%\).

2 A l + 3 H 2 S O 4 → A l 2 S O 4 3 + 3 H 2
x 3/2 x mol
F e + H 2 S O 4 → F e S O 4 + H 2
y y mol
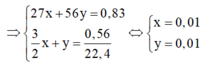
⇒ % m A l = 0,01.27 0,83 .100 = 32,53 % ⇒ % m F e = 100 % − 32,53 % = 67,47 %
⇒ Chọn D.


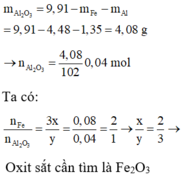
3Fe + 2O2 --> Fe3O4 4Al + 3O2 --> 2Al2O3
x ---------------> x/3 y------------------> y/2
Theo đề bài \(\dfrac{\dfrac{x.232}{3}+\dfrac{y.102}{2}}{56x+27y}\) = \(\dfrac{283}{195}\)
Giải pt => x = 3y
=> %mFe = \(\dfrac{mFe}{mFe+mAl}.100\%\)= \(\dfrac{3y.56}{3y.56+27y}.100\%\) = 86,15%
<=> %mAl = 100 - 86,15 = 13,85%