Tính thể tích khí oxi và thể tích không khí (đktc) cần thiết để đốt cháy: 1mol cacbon
Cho biết oxi chiếm 20% thể tích không khí.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nC = 1,8 : 12 = 0,15 (mol)
pthh : C+O2 --> CO2
0,15>0,15 (mol)
=> V O2 = 0,15 .22,4 = 3,36 (l)
=> Vkk = 3,36 : 1/5 = 16,8 (L)
nZn = 13 : 65 = 0,2 (mol)
pthh : 2Zn + O2 -t-> 2ZnO
0,2-----> 0,1 (mol)
=>VO2 = 0,1.22,4 = 2,24 (l)
=> Vkk = 2,24 : 1/5 = 11,2 (l)
nAl = 2,7 : 27 = 0,1 (mol)
pthh : 4Al + 3O2 --t--->2 Al2O3
0,1-->0,075 (mol)
=> VO2 = 0,075 . 22,4 = 1, 68 (l)
=> VKk = 1,68 : 1/5 = 8,4 (l)
a, nC = 1,8/12 = 0,15 (mol)
PTHH: C + O2 -> (t°) CO2
Mol: 0,15 ---> 0,3
Vkk = 0,3 . 5 . 22,4 = 33,6 (l)
b, nZn = 13/65 = 0,2 (mol)
PTHH: 2Zn + O2 -> (t°) 2ZnO
Mol: 0,2 ---> 0,1
Vkk = 0,1 . 5 . 22,4 = 11,2 (l)
c, nAl = 2,7/27 = 0,1 (mol)
PTHH: 2Al + 3O2 -> (t°) 2Al2O3
Mol: 0,1 ---> 0,075
Vkk = 0,075 . 5 . 22,4 = 8,4 (l)

Phương trình hóa học khi đốt cháy photpho:
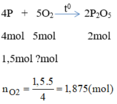
Thể tích của oxi cần: V O 2 = n O 2 .22,4 = 1,875.22,4 = 42(l)
Thể tích của không khí cần dùng là: V k k = 5 V O 2 = 5.42=210(l)

a) PTHH: \(S+O_2\underrightarrow{t^o}SO_2\)
Ta có: \(n_{O_2}=n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\) \(\Rightarrow V_{O_2}=0,1\cdot22,4=2,24\left(l\right)\)
b) PTHH: \(C+O_2\underrightarrow{t^o}CO_2\)
Ta có: \(n_{O_2}=n_C=\dfrac{6}{12}=0,5\left(mol\right)\) \(\Rightarrow V_{O_2}=0,5\cdot22,4=11,2\left(l\right)\)
a. PT: S + O2 ---> SO2.
Ta có: nS=3,2/32=0,1(mol)
Theo PT, ta có: nS=nO=0,1(mol)
=> VO=0,1.22,4=2,24(l)
=> Vkk=5.VO=5.2,24=11,2(l)
b. PT: C + O2 ---> CO2.
Ta có: nC=6/12=0,5(mol)
Theo PT, ta có: nC=nO=0,5(mol)
=> VO=0,5.22,4=11,2(l)
=> => Vkk=5.VO=5.11,2=56(l)

Theo gt ta có: $n_{H_2}=0,75(mol)$
a, $2H_2+O_2\rightarrow 2H_2O$
Ta có: $n_{O_2}=0,5.n_{H_2}=0,375(mol)\Rightarrow V_{O_2}=8,4(l)\Rightarrow V_{kk}=42(l)$
b, $2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2$
Ta có: $n_{KMnO_4}=2.n_{O_2}=0,75(mol)\Rightarrow m_{KMnO_4}=118,5(g)$
a)
\(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ V_{O_2} = \dfrac{V_{H_2}}{2} = \dfrac{16,8}{2} = 8,4(lít)\\ V_{không\ khí} = \dfrac{8,4}{20\%} = 42(lít)\)
b)
\(n_{O_2} = \dfrac{8,4}{22,4} = 0,375(mol)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4} = 2n_{O_2} = 0,75(mol)\\ \Rightarrow m_{KMnO_4} = 0,75.158 = 118,5(gam)\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = 0,25(mol)\\ \Rightarrow m_{KClO_3} = 0,25.122,5 = 30,625(gam)\)

C+O2-to>CO2
1,5--1,5 -----1,5mol
n C=\(\dfrac{18}{12}\)=1,5 mol
=>Vkk=1,5.22,4.5=168l
=>VCO2=1,5.22,4=33,6l
nC = 18/12 = 1,5 (mol)
PTHH: C + O2 -> (t°) CO2
Mol: 1,5 ---> 1,5 ---> 1,5
VO2 = 1,5 . 22,4 = 33,6 (l)
Vkk = 33,6 . 5 = 168 (l)
VCO2 = 1,5 . 22,4 = 33,6 (l)

a) PTHH: 4P+5O2-----to---> 2P2O5
0,2 0,25 0,1
b)\(n_{P_2O_5}=\dfrac{m}{M}=\dfrac{14,2}{142}=0,1\left(mol\right)\)
\(m_P=n.M=0,2.31=6,2\left(gam\right)\)
c) \(V_{O_2}=n.22,4=0,25.22,4=5,6\left(l\right)\)

\(n_{C_2H_4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PT: \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
Theo PT: \(n_{O_2}=3n_{C_2H_4}=0,75\left(mol\right)\Rightarrow V_{O_2}=0,75.22,4=16,8\left(l\right)\)
\(\Rightarrow V_{kk}=\dfrac{V_{O_2}}{20\%}=84\left(l\right)\)
Phương trình phản ứng khi đốt cháy cacbon:
V O 2 = n O 2 .22,4 = 1.22,4 = 22,4(l)
→ V k k = 5 V O 2 = 5.22,4 = 112(l)