Một hiđrocacbon X cộng hợp với axit HCl theo tỉ lệ mol 1:1 tạo sản phẩm có thành phần khối lượng clo là 45,223%. Công thức phân tử của X là:
A. C4H8.
B. C3H4.
C. C2H4.
D. C3H6.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

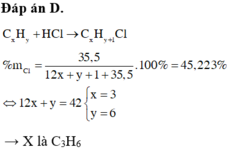

M sản phẩm = 35,5 : 45,223% = 78,5 ⇒ MX = 78,5 – 35,5 - 1 = 42
⇒ X là C3H6.
Đáp án A.

Đáp án A
Giả sử X có công thức CnH2n
Khi X tham gia phản ứng với HCl thu được sản phẩm có công thức CnH2n+1Cl
%Cl =
35
,
5
14
n
+
36
,
5
×100% = 45,223% → n= 3 (C3H6).

- Theo bài ra ta có CTTQ của X là C n H 2 n (n ≥ 2)
- PTHH:
![]()
- Sản phẩm thu được có % m Cl = 45,223
![]()
- Vậy có CTPT là C 3 H 6 . Chọn đáp án A.

Đáp án C
Đặt CTPT của sản phẩm có dạng RCl
%mCl = 45,223% → ![]()
Giải PT được R = 43.
Vậy dẫn xuất halogen là C3H7Cl
Vậy X là C3H8.

Đáp án B
Hiđrocacbon X cần tìm là CxHy
→ sản phẩm là CxHy + 1Cl
Ta có: %Cl =
35
,
5
12
x
+
y
+
36
,
5
= 55,04% → 12x + y = 28
Biện luận x = 2, y = 4 thoả mãn → X là C2H4