Cho biết: Na: 23; O: 16; S: 32; Fe: 56; Al: 27 . Phân tử khối của Na₂O, Al₂(SO₄)₃ , Fe₂O₃. Lần lượt là :
A) 62 đvC, 342 đvC, 160g
B) 62 g, 342 đvC, 160 đvC
C) 62 đvC, 342g, 160 đvC
D) 62 đvC, 342 đvC, 160 đvC
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: nC= \(\dfrac{1,9926.10^{-23}}{12}\) = 1,6605.10-24
=> mNa = ( 1,6605. 10-24) .23= 3,81915.10-23

\(^{23}_{11}Na\\ \Rightarrow\left\{{}\begin{matrix}P=E=Z=11\\N=A-Z=23-11=12\end{matrix}\right.\\ ^{19}_9F\\ \Rightarrow\left\{{}\begin{matrix}P=E=Z=9\\N=A-Z=19-9=10\end{matrix}\right.\)


Đề bài là đốt hỗn hợp Na + Ca trong không khí bạn nhỉ?
a, PT: \(4Na+O_2\underrightarrow{t^o}2Na_2O\)
\(2Ca+O_2\underrightarrow{t^o}2CaO\)
b, Giả sử: \(\left\{{}\begin{matrix}n_{Na}=x\left(mol\right)\\n_{Ca}=y\left(mol\right)\end{matrix}\right.\)
⇒ 23x + 40y = 4,3 (1)
Theo PT: \(\left\{{}\begin{matrix}n_{Na_2O}=\frac{1}{2}n_{Na}=\frac{1}{2}x\left(mol\right)\\n_{CaO}=n_{Ca}=y\left(mol\right)\end{matrix}\right.\)
⇒ 62.1/2x + 56y = 5,9
⇒ 31x + 56y = 5,9 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Na}=0,1.23=2,3\left(g\right)\\m_{Ca}=0,05.40=2\left(g\right)\end{matrix}\right.\)
Bạn tham khảo nhé!

Đáp án D
Do các khí đo ở cùng điều kiện nên ta “có thể” coi V như số mol để tính cho đơn giản.
TH1:
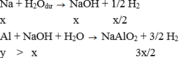
TH2:
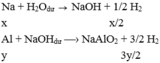
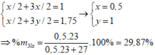

Ta có: \(^{23}_{11}Na \rightarrow ^{22}_{11}Na+^1_0n\)
Năng lượng cần để bứt một nơ trôn ra khỏi hạt nhân của \(^{23}_{11}Na\) bằng năng lượng thu vào của phản ứng trên,
Tính bằng: \((21,9944+1,008665-22,9897).931=12,42MeV\)
Chọn A.
Chúc bạn học tốt ![]() và nhớ tích đúng cho mình nhé
và nhớ tích đúng cho mình nhé ![]()

PTK:
Cl2: 35,5 . 2 = 71 đvC
CuSO4: 64.1 + 32.1 + 16.4 = 160 đvC
HCl: 1.1 + 35,5.1 = 36,5 đvC
NaOH: 23.1 + 16.1 + 1.1 = 40 đvC
D
D