Hoà tan hoàn toàn 6 gam hỗn hợp gồm Cu – Fe bằng dung dịch HCl. Phản ứng kết thúc thu được 1,12 lít khí đktc. Phần trăm theo khối lượng của Fe trong hỗn hợp ban đầu là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,05 0,05
\(n_{Fe}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
\(m_{Fe}=0,05.56=2,8\left(g\right)\)
\(m_{Cu}=6-2,8=3,2\left(g\right)\)
0/0Fe = \(\dfrac{2,8.100}{6}\simeq46,7\)0/0
⇒ Chọn câu : B
Chúc bạn học tốt

Đáp án A
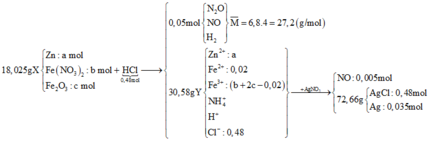
BTKL: mX + mHCl = mKhí + mY + mH2O
=> mH2O = 18,025 + 0,48.36,5 – 27,2.0,05 – 30,585= 3,6 (g) => nH2O = 0,2 (mol)
nH+dư ( trong Y) = 4nNO = 4. 0,005 = 0,02 (mol)
BTNT Cl => nAgCl = 0,48 (mol) => nAg = ( 72,66 – 0,48.143,5)/108 = 0,035 (mol)
Gọi a, b, c lần lượt là số mol của Zn, Fe(NO3)2 và Fe2O3 trong X
=> mX = 65a + 180b + 160c = 18,025 (1)
BTNT O: 6nFe(NO3)2 + 3nFe2O3 = nN2O + nNO + 2nH2O
=> nN2O + nNO = 6b + 3c -0,2
=> nH2 = ∑ nKhí - nN2O + nNO = 0,25 – 6b – 3c
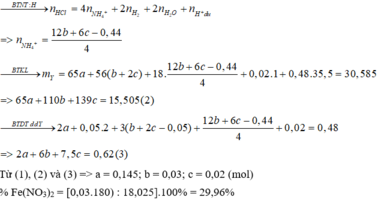

Giải thích: Đáp án B
Số mol H2 là 0,05 mol
PTHH: Fe + 2HCl → FeCl2 +H2
Suy ra nFe = 0,05 mol → mFe = 2,8 → %Fe = 56%

Gọi x,y lần lượt là số mol của Al, Fe
nH2 = \(\dfrac{8,96}{22,4}\)=0,4 mol
Pt: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
......x.................................0,5x...........1,5x
.....Fe + H2SO4 --> FeSO4 + H2
.......y..........................y............y
Ta có hệ pt:
{27x+56y=11
1,5x+y=0,4
⇔x=0,2, y=0,1
% mAl = \(\dfrac{0,2.27}{11}\).100%=49,1%
% mFe = \(\dfrac{0,1.56}{11}\).100%=50,9%
mAl2(SO4)3 = 0,5x . 342 = 0,5 . 0,2 . 342 = 34,2 (g)
mFeSO4 = 152y = 152 . 0,1 = 15,2 (g)
Gọi CTTQ: MxOy
Pt: MxOy + yH2 --to--> xM + yH2O
\(\dfrac{0,4}{y}\)<-------0,4
Ta có: 232,2=\(\dfrac{0,4}{y}\)(56x+16y)
⇔23,2=\(\dfrac{22,4x}{y}\)+6,4
⇔\(\dfrac{22,4x}{y}\)=16,8
⇔22,4x=16,8y
⇔x:y=3:4
Vậy CTHH của oxit: Fe3O4

Đáp án A
Đặt nFe = a và nAl = b.
+ Phương trình theo khối lượng hỗn hợp: 56a + 27b = 9,65 (1)
+ Phương trình bảo toàn e là: 2a + 3b = 2nH2 = 0,65 (2)
+ Giải hệ (1) và (2) ⇒ nAl = b = 0,15 mol
⇒ %mAl = 0,15×27/9,65 × 100 ≈ 41,97%

Chọn đáp án B
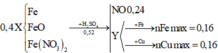
Y có thể gồm các ion thuộc 1 trong 3 trường hợp:
TH1: Fe2+ (có thể), Fe3+, H+, S O 4 2 -
TH2: Fe2+ (có thể), N O 3 - , S O 4 2 -
TH3: Fe3+, H+, N O 3 - , S O 4 2 -
Lượng Cu và Fe hoà tan tối đa là như nhau Þ Chỉ có thể là TH2 hoặc TH3 vì TH1 có H+ mà không
có N O 3 - Þ Tạo thêm H2, làm cho lượng Fe tối đa hoà tan được nhiều hơn Cu
nCu max = nFe max = 0,16 Þ Số mol Fe3+ trong Y tối đa = 0,16x2 = 0,32
Với TH3 thì nFe3+ = 0,4 Þ Chỉ có TH2 thỏa mãn Y
Trong đó Y chứa: Fe3+ (0,32 mol), Fe2+ (0,08 mol), N O 3 - , S O 4 2 - (0,52 mol)
BTĐT Þ nNO = 0,32x3 + 0,08x2 - 0,52x2 = 0,08
Bán phản ứng Þ nFeO = (0,52x2 - 0,24x4)/2 = 0,04
BTNT.N Þ nFe(NO3)2 = (0,24 + 0,08)/2 = 0,16 Þ nFe = 0,4 - 0,16 - 0,04 = 0,2
Vậy %Fe(NO3)2 = ![]()


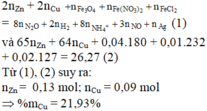
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\\ PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\\ \Rightarrow n_{Fe}=0,05\left(mol\right)\\ \Rightarrow m_{Fe}=0,05\cdot56=2,8\left(g\right)\\ \Rightarrow\%_{Fe}=\dfrac{2,8}{6}\cdot100\%\approx46,67\%\\ \Rightarrow\%_{Cu}\approx100\%-46,67\%=53,33\%\)
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,05 0,05
\(m_{Fe}=0,05\cdot56=2,8g\)
\(\%m_{Fe}=\dfrac{2,8}{6}\cdot100\%=46,67\%\)