Nung m gam bột sắt trong oxi, thu được 3 gam hỗn hợp chất rắn X. Hòa tan hết hỗn hợp X trong dung dịch HNO3 (dư), thoát ra 0,56 lít (ở đktc) NO (là sản phẩm khử duy nhất). Giá trị của m là
A. 2,52.
B. 2,22.
C. 2,62.
D. 2,32.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Có: nNO = 0,025mol.
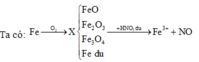
Trong trường hợp này ta có thể quy đổi hỗn hợp X về các hỗn hợp khác đơn giản gồm hai chất (Fe và Fe2O3; FeO và Fe2O3; Fe3O4 và Fe2O3; Fe và FeO; Fe và Fe3O4; FeO và Fe3O4 hoặc thậm chí chỉ một chất FexOy )
Do đó ta có thể giải bài tập theo một trong những cách như sau:
Cách 1: Quy đổi hỗn hợp X thành Fe và Fe2O3
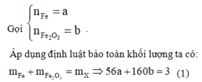
Khi cho hỗn hợp gồm Fe và Fe2O3 tác dụng với dung dịch HNO3 thì chỉ có Fe thay đổi số oxi hóa từ 0 lên +3. Áp dụng định luật bảo toàn mol electron, ta có:
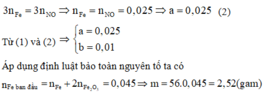

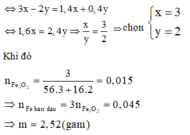
Cách 3: Quy đổi hỗn hợp ban đầu về hỗn hợp gồm Fe và O.
Các quá trình nhường và nhận electron:
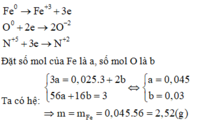
Đáp án A

Fe + O2 → hỗn hợp rắn X
Theo ĐL Bảo toàn khối lượng có mO2= 3-m (gam) → nO2= (3-m)/32 mol
Ta có nNO= 0,025 mol
QT cho e:
Fe→ Fe3++ 3e
m/56 3m/56 mol
QT nhận e :
O2+ 4e→ 2O-2
(3-m)/32 (3-m)/8
N+5+ 3e → NO
0,075←0,025
Theo ĐL BT electron thì : ne cho= ne nhận
Nên 3m/56= (3-m)/8+ 0,075 Suy ra m= 2,52 gam
Đáp án A

Khí thoát ra : NO2
Coi hỗn hợp X gồm Fe,O
Ta có :
\(n_{Fe} = \dfrac{7,28}{56} =0,13(mol) ; n_{NO_2} = \dfrac{1,568}{22,4} =0,07(mol)\)
Bảo toàn e :
\(3n_{Fe} = 2n_O + n_{NO_2}\Rightarrow n_O = \dfrac{0,13.3-0,07}{2} =0,16 \ mol\)
Suy ra : \(m_X = m_{Fe} + m_O = 7,28 + 0,16.16 = 9,84(gam)\)
Đáp án A.
Gọi
Bảo toàn khối lượng: m r ắ n = m F e + m O 2 → 56 x + 32 y = 3
Quá trình cho – nhận e:
Bảo toàn e: 3x = 4y + 0,075 (2)
Từ (1) và (2)