Cho từ từ 27,40 gam Ba vào 100 gam dung dịch H2SO4 9,80%, sau khi phản ứng kết thúc thu được m gam kết tủa, dung dịch X và khí Y. Nồng độ phần trăm của chất tan có trong dung dịch Y là
A. 16,49%.
B. 13,42%.
C. 16,52%.
D. 16,44%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nNa = 6.9 : 23 = 0.3 mol
4Na + O2 ->2 Na2O
mol : 0.3 -> 0.15
Na2O + H2O -> 2NaOH
mol : 0.15 -> 0.3
mdd = 0.15 x 62 + 140.7 = 150g
C% NaOH = 0.3x40: 150 x 100% = 8%

Đáp án C
Nhận thấy sau 1 thời gian mới bắt đầu xuất hiện kết tủa → chứng tỏ trong dung dịch chứa H+ dư
Dựa vào đồ thị tại 17a mol OH- kết tủa không đổi → chỉ chứa Mg(OH)2 : 2a mol → nMg= 2a mol
Lượng kết tủa cực đại chứa Mg(OH)2 : 2a mol, Al(OH)3 : 3a mol → nAl2O3 = 1,5a mol
→ 2a. 24+ 1,5a . 102 = 12, 06 → a = 0,06 mol
Gọi số mol của HCl và H2SO4 lần lượt là0,5b và 0,1b
Dung dịch X chứa Mg2+ : 0,12 mol, Al3+ : 0,18 mol, Cl-:0,5b mol, SO42- :0,1b mol H+ dư : 0,7b- 0,78 ( bảo toàn điện tích)
Tại thời điểm 17a mol OH- thì nOH- = 4nAl3+ + 2nMg2+ + nH+ dư → 17. 0,06 = 4. 0,18 + 2.0,12 + 0,7b- 0,78 → b = 1,2
Khi thêm :
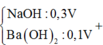


Kết tủa cực đại khi chưa ra sự hòa tan kết tủa thì nOH- = nH+ dư + 2nMg2+ + 3nAl3+ = 0,84
→ 0,5V = 0,84 → V = 1,68 lít → nBa2+ = 0,168 mol
Khi đó nBaSO4 = nSO42- = 0,12 mol
Chất rắn khan chứa BaSO4:0,12 mol; MgO: 0,12 mol; Al2O3: 0,09 mol → m = 41,94 gam
Chọn đáp án A.