Đốt cháy hoàn toàn 7,2 gam kim loại M (có hóa trị không đổi) cần 5,6 lít hỗn hợp khí gồm Cl2 và O2 (đktc). Phản ứng hoàn toàn thu được 23 gam hỗn hợp chất rắn. Kim loại M là
A. Ca
B. Cu
C. Zn
D. Mg
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án C
Đặt nCl2 = x; nO2 = y ⇒ nkhí = x + y = 0,25 mol. Bảo toàn khối lượng:
7,2 + 71x + 32y = 23 ||⇒ giải hệ có: x = 0,2 mol; y = 0,05 mol.
Gọi n là hóa trị của M. Bảo toàn electron: n × nM = 2nCl2 + 4nO2.
⇒ nM = 0,6 ÷ n ⇒ MM = 7,2 ÷ (0,6 ÷ n) = 12n.
⇒ n = 2 và MM = 24 ⇒ M là Magie (Mg) ⇒ chọn C.

Đáp án C
Đặt nCl2 = x; nO2 = y ⇒ nkhí = x + y = 0,25 mol.
Bảo toàn khối lượng:
7,2 + 71x + 32y = 23 ||
⇒ giải hệ có: x = 0,2 mol; y = 0,05 mol.
Gọi n là hóa trị của M.
Bảo toàn electron: n × nM = 2nCl2 + 4nO2.
⇒ nM = 0,6 ÷ n
⇒ MM = 7,2 ÷ (0,6 ÷ n) = 12n.
⇒ n = 2 và MM = 24 ⇒ M là Magie (Mg)

Giải thích: Đáp án C
Bảo toàn khối lượng m↑ = 23-7,2 =15,8 g
→ hỗn hợp khí có Cl2 : 0,2 mol và O2 :0,05 mol
Đặt hóa trị của M là x
Bảo toàn e có 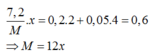
→x=2 và M =24 (Mg)

Chọn A
Cách 1:
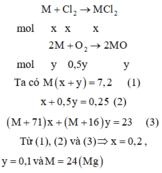
Cách 2:
Gọi số mol của Cl2 và O2 phản ứng lần lượt là x và y mol
→ nkhí = 0,25 mol → x + y = 0,25 (1)
Bảo toàn khối lượng có mkhí= 23 – 7,2= 15,8 gam
→ 71x + 32y = 15,8 (2)
Từ (1) và (2) → x = 0,2 và y = 0,05
Bảo toàn electron có:
2.nM = 2.nCl2 + 4.nO2 → nM= 0,3 → MM = 7,2 : 0,3 = 24 (g/mol)
Vậy kim loại M là Mg.

Đáp án A
mrắn sau − mM = mX ⇒ 71nCl2 + 32nO2 = 23 − 7,2 = 15,8 g (1)
⇒nkhí = nCl2 +nO2 = 0,25 mol (2)
Giải hệ (1) và (2) ⇒nCl2 = 0,2; nO2 = 0,05 mol
Gọi hóa trị của M là x
Bảo toàn e

M = ![]() = 12x, x = 2 => M = 24 (Mg)
= 12x, x = 2 => M = 24 (Mg)
Chọn D