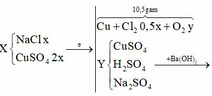
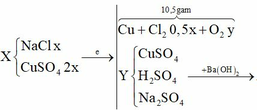
Cho 60 gam tinh thể CuSO4.5H2O vào dung dịch NaCl, thu được dung dịch X. Tiến hành điện phân dung dịch X bằng điện cực trơ, màng ngăn xốp đến khi khối lượng dung dịch giảm 24,88 gam thì dừng điện phân, thu được dung dịch Y chỉ chứa hai chất tan và ở anot thoát ra V lít khí (đktc). Nhúng thanh Mg vào Y, kết thúc phản ứng, thấy khối lượng thanh Mg giảm 3,36 gam. Giá trị của V là:
A. 3,584 lít
B. 3,920 lít
C. 3,808 lít
D. 4,032 lít



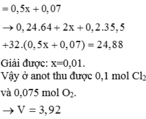

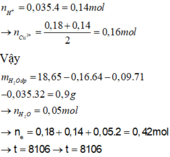
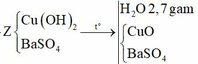
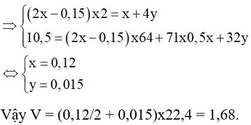
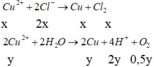
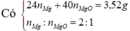
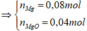
Đáp án B
Ta có: n C u S O 4 . 5 H 2 O = 0 , 24 m o l
Điện phân X đến khi dung dịch giảm 24,88 gam thì dừng. Dung dịch thu được 2 chất tan. Cho Mg vào Y thấy thành Mg giảm 3,36 gam chứng tỏ có H+.
Do vậy hai chất tan trong Y là H2SO4 và Na2SO4
n H 2 S O 4 = n M g = 0 , 14 m o l
Cu2+ bị điện phân hết và có sinh ra 0,28 mol H+ → n C l 2 = 0 , 24 . 2 - 0 , 28 2 = 0 , 1
Dung dịch bị giảm do Cu2+, Cl- và H2O bị điện phân.
Gọi số mol H2 tạo ra ở catot là x → n O 2 = 2 x + 0 , 24 . 2 - 0 , 1 . 2 4 = 0 , 5 x + 0 , 07 → 0 , 24 . 64 + 2 x + 0 , 2 . 35 , 5 + 32 ( 0 , 5 x + 0 , 07 ) = 24 , 88
Giải được: x=0,01.
Vậy ở anot thu được 0,1 mol Cl2 và 0,075 mol O2.
=> V= 3,92