Từ 6,2 kg photpho điều chế được bao nhiêu lít dung dịch H3PO4 2M (hiệu suất toàn bộ quá trình là 80%)
A. 100 lít.
B. 80 lít.
C. 40 lít.
D. 60 lít.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
Ta có 6,2 kg = 6200 g
+ Ta có 1P → 1H3PO4.
⇒ nH3PO4 = nP × 0,8 = 6200 × 0,8 ÷ 31 = 160 mol.
⇒ VH3PO4 = 160 ÷ 2 = 80 lít ⇒ Chọn B

Đây là một câu dễ trong đề đại học, đề bài rất ngắn gọn nhưng cần tỉnh táo để tiết kiệm thời gian.
+ Nhận thấy lượng P ban đầu được bảo toàn thành P trong HNO3 80% vì hiệu suất cả quá trình điều chế là 80%.
+ Ta có
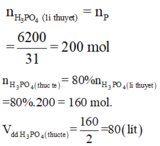
Đáp án B

Đáp án : D
Giả sử cần mg quặng => mCa3(PO4)2 = 0,95m (g)
=> Thực tế chỉ có 0,8.0,95m = 0,76m (g) Ca3(PO4)2 phản ứng
Ca3(PO4)2 -> 2H3PO4
310g 2.98g
0,76m(g) 980g
=> m = 2040g = 2,04 kg

Đáp án C
Các phương trình điều chế HNO3 từ NH3
4NH3 + 5O2 ![]() 4NO + 6H2O
4NO + 6H2O
2NO + O2→2NO2
4NO2 + O2 + 2H2O→ 4HNO3
Theo bảo toàn nguyên tố N ta có:
nHNO3=nNH3=112 000/22,4=5000 mol
→mHNO3=315 000 gam= 315 kg
→ mddHNO3= 315.100/60=525 kg
Do hiệu suất bằng 80% nên mddHNO3 thực = mPT.80/100= 525.80/100=420 kg

Đáp án C
Hướng dẫn
Với H = 64,8 % thì số mol của C2H5OH thu được là :

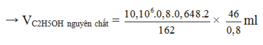
Vậy thể tích dung dịch cồn thực phẩm 40 0 thu được
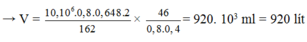

Đáp án: C
Với H = 64,8 % thì số mol của C2H5OH thu được là :

Chọn đáp án B
Ta có 6,2 kg = 6200 g
+ Ta có 1P → 1H3PO4.
⇒ nH3PO4 = nP × 0,8
= 6200 × 0,8 ÷ 31
= 160 mol.
⇒ VH3PO4 = 160 ÷ 2 = 80 lít