Nhiệt phân hoàn toàn 100 gam mẫu đá vôi thu được 20,37 lít CO2 ở đktc. Tìm hàm lượng phần trăm của CaCO3.
A. 53,62%.
B. 81,37%.
C. 95,67%
D. 95,67%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
CaCO3→CaO+CO2
nCO2=nCaCO3=20,37/22,4=0,9094 mol
=> mCaCO3=0,9094.100=94,94 gam
=> %mCaCO3=90,94/100=90,94%
Đáp án D

nCaCO3 = nCO2 = 20,37 ÷ 22,4 = 0,9094 mol
⇒%mCaCO3 = 0,909375 × 100 ÷ 100 .100% = 90,94%
Đáp án C

\(n_{CO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: CaCO3 --to--> CaO + CO2
_______0,4<-----------------------0,4______(mol)
=> \(m_{CaCO_3}=0,4.100=40\left(g\right)\)
=> \(\%m_{CaCO_3}=\dfrac{40}{50}.100\%=80\%\)

a) PTHH: \(CaCO_3\underrightarrow{t^o}CaO+CO_2\)
b) mCaCO3 = \(\frac{120.90}{100}=108\left(gam\right)\)
=> nCaCO3 = 108 / 100 = 1,08 (mol)
=> nCaO = nCO2 = nCaCO3 = 1,08 (mol)
=> mCaO = 1,08 x 56 = 60,28 (gam) = a
=> VCO2(đktc) = 1,08 x 22,4 = 24,192 (lít) = b

`a)`
`n_{CO_2} = (100,8)/(22,4) = 4,5(mol)`
$PTHH: CaCO_3 \xrightarrow{t^o} CaO + CO_2$
Theo PT: `n_{CaCO_3} = n_{CO_2} = 4,5(mol)`
`=> m_{CaCO_3} = 4,5.100 = 450(g)`
`=> m=m_{đá.vôi} = (450)/(90\%) = 500(g)`
`b)`
`n_{CaCO_3(ban.đầu)} = (4,5)/(80\%) = 5,625(mol)`
`=> m_{CaCO_3} = 5,625.100 = 562,5(g)`
`=> m=m_{đá.vôi} = (562,5)/(90\%) = 625(g)`
`c)`
`M_{Khí} = 14,75.2 = 29,5(g/mol)`
Áp dụng sơ đồ đường chéo, ta có:
`(V_{O_2})/(V_{N_2}) = (29,5-28)/(32-29,5) = 3/5`
Vậy trộn `N_2,O_2` the tỉ lệ thể tích `V_{O_2} : V_{N_2} = 3:5` thì thu được hỗn hợp khí có tỉ khối với `H_2` là `14,75`

Na2CO3 không bị nhiệt phân, nên 2,24 lít khí sinh ra chính là CO2 do CaCO3 bị nhiệt phân theo phản ứng
![]()
Cách 1:
![]()
Áp dụng định luật bảo toàn khối lượng ta có:
m X = m c h ấ t r ắ n + m C O 2 = 11,6 + 0,1.44 = 16 (gam)
Vậy phần trăm khối lượng của CaCO3 trong hỗn hợp X là:
![]()
Cách 2:
Ta có:
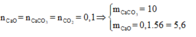
Hỗn hợp rắn thu được gồm CaO và Na2CO3
![]()
![]()
Đáp án D
Đáp án D