Đốt cháy hoàn toàn 4,3 gam chất hữu cơ X, rồi dẫn toàn bộ sản phẩm đốt cháy vào dung dịch Ca(OH)2 dư có 20 gam kết tủa xuất hiện, độ giảm khối lượng dung dịch là 8,5 gam. Biết MX < 100. CTPT của X là
A. C5H10O2
B. C3H6O2
C. C4H8O2
D. C4H6O2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án: D
n
C
O
2
=
0
,
2
Khối lượng dung dịch giảm:
m
C
O
2
+
m
H
2
O
-
m
C
a
C
O
3
=
-
8
,
5
⇒
n
H
2
O
=
0
,
15
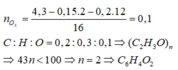

Đáp án B
nCaCO3 = 0,18 mol
nCa(OH)2 = 0,24 mol
BTNT “Ca” ta có: nCa(HCO3)2 = nCa(OH)2 – nCaCO3 = 0,24 – 0,18 = 0,06 mol
BTNT “C”: nCO2 = nCaCO3 + 2nCa(HCO3)2 = 0,18 + 2.0,06 = 0,3 mol => nC = 0,3 mol
Mặt khác, m dd tăng = mCO2 + mH2O – mCaCO3 => 2,4 = 0,3.44 + mH2O – 18
=> mH2O = 7,2 gam => nH2O = 0,4 mol => nH = 0,8 mol
mO(hchc) = mhchc – mC – mH = 9,2 – 0,3.12 – 0,8.1 = 4,8 gam => nO = 4,8 : 16 = 0,3 mol
C : H : O = 0,3 : 0,8 : 0,3 = 3 : 8 : 3
=> CTPT (C3H8O3)n hay C3nH8nO3n
Trong hchc ta luôn có: H ≤ 2C + 2 => 8n ≤ 2.3n + 2 => n ≤ 1
=> n = 1
Vậy CTPT của hchc là C3H8O3

Đáp án B
, nCO2 = nBaCO3 = 0,2 mol
, mdd giảm = mBaCO3 – (nCO2 + nH2O) => nH2O = 0,35 mol
Xét 6,75g A phản ứng tạo 0,075 mol N2
=> Vậy 4,5 g A thì tạo 0,05 mol N2
=> nN(A) = 0,1 mol
Ta có : mA = mC + mH + mO + mN => nO = 0
=> nC : nH : nN = 0,2 : 0,7 : 0,1 = 2 : 7 : 1
=> CTĐG nhất và cũng là CTPT của A là C2H7N

$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
$n_{CO_2} = n_{CaCO_3} = \dfrac{12}{100} = 0,12(mol)$
Ta có : $m_{bình\ tăng} = m_{CO_2} + m_{H_2O}$
$\Rightarrow m_{H_2O} = 8,16 - 0,12.44 = 2,88(gam)$
$\Rightarrow n_{H_2O} = 0,16(mol)$
Bảo toàn nguyên tố C, H :
$n_C = n_{CO_2} = 0,12(mol)$
$n_H = 2n_{H_2O} = 0,32(mol)$
$\Rightarrow m_O = m_X - m_C - m_H = 1,28(gam) \Rightarrow n_O = \dfrac{1,28}{16} = 0,08(mol)$
Ta có :
$n_C : n_H : n_O = 0,12 : 0,32 : 0,08 = 3 : 8 : 2$
Vậy CTPT của X : $(C_3H_8O_2)_n$
$M_X = 76n = M_{H_2}.38 = 76 \Rightarrow n = 1$
Vậy CTPT là $C_3H_8O_2$
Chọn đáp án D
Khối lượng dung dịch giảm: