Cho 7,1 gam P2O5 vào 100 ml dung dịch KOH 1,5M thu được dung dịch X. Cô cạn dung dịch X được hỗn hợp gồm các chất là:
A. KH2PO4 và H3PO4.
B. KH2PO4 và K2HPO4
C. KH2PO4 và K3PO4.
D. K3PO4 và K2HPO4.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Hướng dẫn giải:
H3PO4 + 2KOH → K2HPO4+ 2H2O
x 2x x mol
H3PO4 + 3KOH → K3PO4 + 3H2O
y 3y y mol
Ta có: nKOH= 2x + 3y= 0,1.2= 0,2 mol
mhỗn hợp muối= 174x + 212 y= 14,95 gam
Giải hệ trên ta có: x= 0,025 mol; y = 0,05 mol → nH3PO4= x+y= 0,075 mol
→ mH3PO4= 0,075. 98= 7,35 gam → mdung dịch H3PO4 35%= 7,35.100/35= 21 (gam)
→Vdd = m/D= 21/1,25= 16,8 ml

Đáp án : B
Ta có : nP2O5 = 0,05 mol ; nKOH = 0,15 mol = 3nP2O5
=> phản ứng tạo KH2PO4 và K2HPO4
P2O5 + 2KOH + H2O -> 2KH2PO4
P2O5 + 4KOH -> 2K2HPO4 + H2O

Đáp án A
Ta có P2O5+ 3H2O→2H3PO4 (1)
H3PO4+ KOH→ KH2PO4+ H2O (2)
H3PO4+ 2KOH→ K2HPO4+2H2O (3)
Đặt số mol K2HPO4 và KH2PO4 đều là x mol
Theo PT (2), (3):
nKOH= nKH2PO4+ 2nK2HPO4 = x + 2x = 3x = 0,03
Suy ra x= 0,01 mol
→ nH3PO4=nKH2PO4+ nK2HPO4= x+ x= 0,02 mol
→nP2O5= ½. nH3PO4= 0,01 mol

So tính axit của \(H_2PO_4^-\) và \(HPO_4^{2-}\)
\(\left(1\right)H_2PO_4^-⇌H^++HPO_4^{2-}\) \(pKa_2=7,12\)
\(\left(2\right)HPO_4^{3-}⇌H^++PO_4^{3-}\) \(pKa_3=12,3\)
Ta thấy PT (1) có xu hướng xảy ra hơn PT (2) => \(HPO_4^{3-}\) có xu hướng tạo ra \(OH^-\)
=> Xét \(H_2PO_4^-\) là axit, \(HPO_4^{3-}\) là base
\(CM_{KH_2PO_4.mới}=\dfrac{0,1.0,1}{0,1+0,05}=\dfrac{1}{15}M\)
\(CM_{K_2HPO_4.mới}=\dfrac{0,05.0,4}{0,1+0,05}=\dfrac{2}{15}M\)
CT tính ph dd đệm: \(ph=pK_{HA}+log\dfrac{C_B}{C_A}\)
\(\Rightarrow ph=7,12+log\dfrac{\dfrac{2}{15}}{\dfrac{1}{15}}=7,42\)

Đáp án B
nP2O5 = 0,2 mol
nKOH = 0,45 mol
PTHH : P2O5 + 3H2O →2H3PO4
Vì
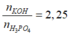
nên phản ứng tạo ra 2 muối K2HPO4 và K3PO4
Đáp án B