Hỗn hợp A (gồm O2 và O3) có tỉ khối so với H2 bằng 136 7 . Hỗn hợp B (gồm etan và propan) có tỉ khối so với H2 bằng 18,5. Để đốt cháy hoàn toàn 0,2 mol B cần phải dùng V lít A (ở đktc). Giá trị của V là
A. 31,36
B. 15,68.
C. 13,44
D. 11,2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MA = 22.2 = 44.
Đặt công thức phân tử trung bình của (O2 và O3) là On
=>16.n =44
=> n =2,75
MB =11,5.2 =23 .
Đặt công thức phân tử trung bình của (CH4 và C2H6) là \(C_mH_{2m+2}\)
=>14m +2 =23
=> m =1,5
Phương trình cháy
\(C_{1,5}H_5+2O_{2,75}\rightarrow1,5CO_2+2,5H_2O\)
0,2(mol)-----> 0,4(mol)
VA =0,4.22,4 = 8,96 (lít)
MA = 22.2 = 44.Đặt công thức phân tử trung bình của (O2 và O3) là On =>16.n =44
=> n =2,75
MB =11,5.2 =23 . Đặt công thức phân tử trung bình của (CH4 và C2H6) là
CmH2m+2 =>14m +2 =23 => m =1,5
Phương trình cháy
C1,5H5 + 2O2,75 -to> 1,5CO2 + 2,5H2O
0,2(mol)-----> 0,4(mol)
VA =0,4.22,4 = 8,96 (lít)

Đáp án B
Nhận thấy :
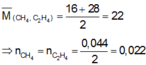
Quy đổi O2 và O3 thành O. Theo bảo toàn electron và bảo toàn khối lượng, ta có :
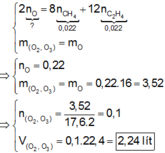

Phân tử khối trung bình của A = 19,2 x 2 = 38,4
Gọi a là tỷ lệ %số mol O2 trong A, ta có phương trình: 32a + 48(1 - a) = 38,4 --> a = 0,6
--> hỗn hợp A có 60% O2 và 40% O3
Phân tử khối trung bình của B = 3,6 x 2 = 7,2
Gọi b là tỷ lệ %số mol H2 trong B, ta có phương trình: 2b + 30(1 - b) = 7,2
--> b = 0,8142857
--> hỗn hợp B có 81,42857% H2 và 18,57143% CO Phương trình phản ứng:
H2 + [O] = H2O (1) CO + [O] = CO2 (2)
Từ phương trình phản ứng, ta thấy số mol nguyên tử [O] cần dùng để đốt cháy hoàn toàn hỗn hợp B bằng đúng số mol hỗn hợp B.
Trong 1 mol A, số mol nguyên tử [O] = 2 x 0,6 + 3 x 0,4 = 2,4 mol nguyên tử [O]. Vậy, số mol A cần dùng để đốt cháy hoàn toàn 1 mol B = 1/2,4 mol
=> Đáp án C
Chọn B
15,68