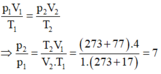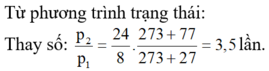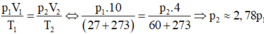Người ta nén 10 lít khí ở nhiệt độ 27 ° C để cho thể tích của khí chỉ còn 4 lít, vì nén nhanh nên khí bị nóng lên đến 60 ° C . Khi đó áp suất của khí tăng lên bao nhiêu lần ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Áp dụng công thức
p 1 V 1 T 1 = p 2 V 2 T 2 ⇒ p 2 p 1 = T 2 V 1 V 2 . T 1 = ( 273 + 60 ) .10 4. ( 273 + 27 ) = 2 , 775

Đáp án A
Áp dụng công thức
p 1 V 1 T 1 = p 2 V 2 T 2 ⇒ p 2 p 1 = T 2 V 1 V 2 . T 1 = 273 + 77 .4 1. 273 + 17 = 7 l ầ n

\(T_1=27^oC=300K\)
\(T_2=60^oC=333K\)
Quá trình khí lí tưởng:
\(\dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\)
\(\Rightarrow\dfrac{p_1\cdot10}{300}=\dfrac{p_2\cdot4}{333}\)
\(\Rightarrow p_1=\dfrac{40}{111}p_2\)
\(\Rightarrow p_2=2,775p_1\)

Đáp án C
Từ phương trình trạng thái:
p 1 V 1 T 1 = p 2 V 2 T 2 ⇒ p 2 p 1 = v 1 v 2 . T 2 T 1
Thay số: p 1 p 2 = 24 8 . 273 + 77 273 + 27 = 3 , 5 lần