Đốt cháy hoàn toàn 8,96 lít khí H2S (đktc), sau đó hoà tan sản phẩm khí X sinh ra vào V ml dung dịch NaOH 25% (d=1,28) thu được 46,88 gam muối. Thể tích dung dịch NaOH cần dùng là
A. 100 ml
B. 120 ml
C. 80 ml
D. 90 ml
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2S}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(H_2S+\dfrac{3}{2}O_2\underrightarrow{^{^{t^0}}}SO_2+H_2O\)
\(0.4.................0.4\)
\(n_{NaOH}=n_{SO_2}=0.4\left(mol\right)\)
=> Tạo muối axit
\(NaOH+SO_2\rightarrow NaHSO_3\)
\(0.4............................0.4\)
\(m_{NaHSO_3}=0.4\cdot104=41.6\left(g\right)\)

a.\(n_{CH_4}=\dfrac{V_{CH_4}}{22,4}=\dfrac{11,2}{22,4}=0,5mol\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,5 1 0,5 ( mol )
\(V_{kk}=V_{O_2}.5=\left(1.22,4\right).5=112l\)
b.\(n_{NaOH}=0,5.0,5=0,25mol\)
\(NaOH+CO_2\rightarrow NaHCO_3\)
0,25 < 0,5 ( mol )
0,25 0,25 ( mol )
\(m_{NaHCO_3}=0,25.84=21g\)
CH4+2O2-to>CO2+2H2O
0,5-----1----------0,5 mol
n CH4=\(\dfrac{11,2}{22,4}\)=0,5 mol
=>Vkk=1.22,4.5=112l
NaOH+CO2->NaHCO3
0,25------0,25-------0,25
n NaOH=0,5.0,5=0,25 mol
=>Tạo ra muối axit, CO2 dư
=>m NaHCO3=0,25.84=21g

n F e S = 8,8/88 = 0,1 mol
⇒ n S O 2 (từ FeS) = 0,1 mol
n F e S 2 = 12/120 = 0,1 mol
⇒ n S O 2 (từ FeS2) = 0,1.2 = 0,2 mol
⇒ n S O 2 = 0,1+0,2 = 0,3 mol
Để chỉ thu được muối trung hòa thì giá trị tối thiểu của NaOH là:
n N a O H = 2.nSO2 = 0,6 mol
⇒ m N a O H = 0,6.40 = 24g
⇒ m d d N a O H = 24.100/25 = 96g
⇒ V d d N a O H = 96/1,28 = 75ml
⇒ Chọn B.

Chọn đáp án A
Chú ý tỉ lệ dung dich X trong mỗi phản ứng
Gọi số mol ion Na+, NH4+, CO32- và SO42- trong 100ml lần lượt a, b, c, d mol
Khi cho X tác dụng với HCl chỉ có CO32- tham gia phản ứng → c = 0,1 mol
Khi cho X tác dụng với BaCl2 thu được BaCO3 và BaSO4 → 0,1.197 + d.233= 43 → d = 0,1 mol
Khi cho X tác dụng lượng dư dung dịch NaOH chỉ có NH4+ tham gia phản ứng → b = 0,2 mol
Bảo toàn điện tích trong dung dịch X → a = 2. 0,1 + 2. 0,1 -0,2 = 0,2 mol
Vậy trong 300ml dung dịch X gồm 0,6 mol Na+, 0,6 mol NH4+, 0,3 mol CO32- và 0,3 mol SO42-
→ m = 0,6.23 + 0,6. 18 + 0,3. 60 + 0,3. 96= 71,4 gam.
Đáp án A.

Chọn đáp án A
Chú ý tỉ lệ dung dich X trong mỗi phản ứng
Gọi số mol ion Na+, NH4+, CO32- và SO42- trong 100ml lần lượt a, b, c, d mol
Khi cho X tác dụng với HCl chỉ có CO32- tham gia phản ứng → c = 0,1 mol
Khi cho X tác dụng với BaCl2 thu được BaCO3 và BaSO4 → 0,1.197 + d.233= 43 → d = 0,1 mol
Khi cho X tác dụng lượng dư dung dịch NaOH chỉ có NH4+ tham gia phản ứng → b = 0,2 mol
Bảo toàn điện tích trong dung dịch X → a = 2. 0,1 + 2. 0,1 -0,2 = 0,2 mol
Vậy trong 300ml dung dịch X gồm 0,6 mol Na+, 0,6 mol NH4+, 0,3 mol CO32- và 0,3 mol SO42-
→ m = 0,6.23 + 0,6. 18 + 0,3. 60 + 0,3. 96= 71,4 gam.
Đáp án A.

Đáp án : B
, nNaOH = nCOO = 0,2 mol
Vì các chất trong X đều có 1 pi => đốt cháy : nCO2 = nH2O
,mbình tăng = mCO2 + mH2O = 40,3g
=> nCO2 = nH2O = 0,65 mol
=> bảo toàn O : 2nCOO + 2nO2 = 2nCO2 + nH2O
=> nO2 = 0,775 mol
=> VO2 = 17,36 lit

Chọn A
Gọi số mol Na + , NH 4 + , CO 3 2 - và SO 4 2 - trong 100ml dung dịch X lần lượt là x, y, z và t.
Bảo toàn điện tích có: x + y – 2z – 2t = 0 (1)
Cho 100ml X tác dụng với HCl dư:
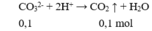
→ z = 0,1 (2)
Cho 100ml X tác dụng với BaCl2 dư:
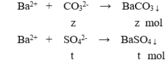
m↓ = 43 (gam) → 197z + 233t = 43 (3)
Cho 100 ml X tác dụng với NaOH
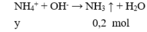
→ y = 0,2 (4)
Từ (1); (2); (3); (4) có x = y = 0,2; z = 0,1; t = 0,1.
Tổng khối lượng muối trong 300ml dung dịch là:
m = 3. (0,2.23 + 0,2.18 + 0,1.60 + 0,1.96) = 71,4 gam.
Đáp án là C. 80 ml