Điện phân dung dịch muối CuSO4 dư trong thời gian 1930 giây, thu được 1,92 gam Cu ở catot. Cường độ dòng điện trong quá trình điện phân là giá trị nào dưới đây:
A. 3A
B. 4,5A
C. 1,5A
D. 6A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn A
Vì CuSO4 dư nên n e = 2 × 1 , 92 / 64 = 0 , 06
⇒ I = 0 , 06 × 96500 / 1930 = 3 A

Đáp án A
Theo định luật Faraday: m = AIt/nF => I = mnF/At : 80% = 3,75 (A)

Theo định luật Faraday ta có khối lượng chất thoát ra ở điện cực là :
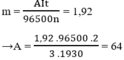
Trong đó A là nguyên tử khối
A = 64 ⇒ A là Cu

Đáp án B
Dung dịch X chứa FeCl2, FeCl3, CuCl2 và HCl dư
Khi ne=0,12 thì khối lượng catot bắt đầu tăng

Giải được: a=0,1; b=0,04.
Dung dịch X chứa HCl dư 0,04 mol, FeCl3 0,12 mol, FeCl2 0,18 mol (bảo toàn Fe), CuCl2 0,04 mol.
Sau điện phân dung dịch Y chứa FeCl2 0,24 mol.
Cho AgNO3 dư vào Y thu được kết tủa gồm Ag 0,24 mol và AgCl 0,48 mol
=> m = 94,8 gam

Đáp án D
+) Catot: M2+ + 2e → M
2H2O + 2e → 2OH- + H2
+) Anot: 2H2O → O2 + 4H+ + 4e
- Xét t giây: nước chưa bị điện phân ở catot
=> nkhí = nO2 = 0,035 mol và ne tđ = 2nM = 4nO2 => nM = 2nO2 = 0,07 mol
- Xét 2t giây => nO2 = 2.0,035 = 0,07 mol
=> nH2 (catot) = 0,1245 – 0,07 = 0,0545 mol (Nước bị điện phân ở catot => M2+ bị điện phân hết)
=> ne tđ = 2nMSO4 + 2nH2 = 4nO2 => nMSO4 = 0,0855 mol
=> MMSO4 = 13,68: 0,0855 = 160 => M = 64 (Cu)
y = mCu (t giây) = 64.0,07 = 4,48g

Đáp án D
Ta có nMgO = 0,3 mol ⇒ nO2↑ khi chưa sinh ra H2 = 0,15 mol.
Đặt nCu = a || nH2 = b ⇒ ∑nO2↑ = 0,15 + 0,5b || nCl2 = c ta có:
+ PT theo khí thoát ra ở 2 cực: 1,5b + c = 0,25 (1).
+ PT bảo toàn e: 2a – 2c = 0,6 (2).
+ PT theo tỉ lệ n C u n C l = 2 : a – 4c = 0 (3).
+ Giải hệ (1) (2) và (3) ⇒ a = 0,4, b = c = 0,1 <=> nCl2 = 0,1.
⇒ Ở 2t giây tổng số mol e nhường = 2nCl2 + 4nO2 = 1 mol.
⇒ Tổng số mol e nhường ở t giây = 1 ÷ 2 = 0,5.
⇒ V lít khí gồm 0,1 mol Cl2 và 0,075 mol O2.
⇒ V = (0,1 + 0,075) × 22,4 = 3,92 lít
Đáp án A.