Oxi hoá hoàn toàn m gam kim loại X cần vừa đủ 0,25m gam khí O 2 . X là kim loại nào sau đây
A. Cu
B. Ca
C. Al
D. Fe
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

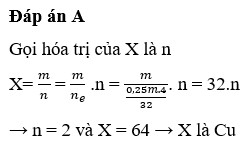

Đáp án C
Chọn m = 32 gam
⇒ ![]() = 0,25 mol
= 0,25 mol
Bảo toàn electron
⇒ nX.n = 0,25.4 ⇒ X=32n ⇒ n=2; X=64 (Cu)

Đáp án C.
Gọi nguyên tử khối của kim loại M cũng là M, có hóa trị là x, ta có:
n M = 18/M (mol); n HCl = 0,8 x 2,5 = 2 mol
Phương trình hóa học
2M + 2xHCl → 2 MCl x + x H 2
Có: 18/M x 2x = 4 → M = 9x
Xét bảng sau
| X | I | II | III |
| M | 9 | 18 | 27 |
Chỉ có kim loại hóa trị III ứng với M = 27 là phù hợp, kim loại M là nhôm (Al)

Đáp án D.
Gọi nguyên tử khối của kim loại R cũng là R và có hoá trị là x.
4R + x O 2 → 2 R 2 O x
Theo đề bài ta có :
32x/4R = 0,4 → R = 20x
Ta có bảng
| X | I | II | III |
| R | 20 | 40 (nhận) | 60 (loại) |
R là Ca có nguyên tử khối là 40.

4M+xO2--->2M2Ox
nO2=7,8125.10^-3.m
-->nM=0,03125m/x
---> M =32x
với x=2 --->M=64(Cu)

Đáp án C.
Gọi công thức của oxit kim loại là MxOy
Số mol H2 là nH2 = 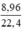 = 0,4(mol)
= 0,4(mol)
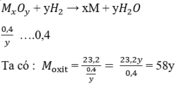
Như vậy :
Mx + 16y = 58y
Mx = 42y
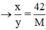
Giá trị thỏa mãn : M = 56; x = 3; y = 4
Kim loại là Fe và công thức oxit là Fe3O4

\(n_{O_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(n_{H_2}=\dfrac{10.08}{22.4}=0.45\left(mol\right)\)
\(n_{Fe}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{^{^{t^0}}}Fe_3O_4\)
\(a.......\dfrac{2a}{3}\)
\(4Al+3O_2\underrightarrow{^{^{t^0}}}2Al_2O_3\)
\(b.......\dfrac{3b}{4}\)
\(n_{O_2}=\dfrac{2a}{3}+\dfrac{3b}{4}=0.25\left(mol\right)\left(1\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(n_{H_2}=a+1.5b=0.45\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.15,b=0.2\)
\(m_{Fe}=0.15\cdot56=8.4\left(g\right)\)
\(m_{Al}=0.2\cdot27=5.4\left(g\right)\)
\(\%m_{Fe}=\dfrac{8.4}{8.4+5.4}\cdot100\%=60.8\%\)
\(\%m_{Al}=100-60.8=39.2\%\)