Cho dư hỗn hợp Na, Mg vào 73,6 gam dung dịch H2SO4 26,63% thì thể tích khí H2 thoát ra (ở đktc) là
A. 33,60 lít
B. 38,08 lít
C. 4,48 lít
D. 4,57 lít
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

HD:
Thí nghiệm 1 chỉ có Na phản ứng:
Na + HOH \(\rightarrow\) NaOH + 1/2H2 (1)
0,4 0,2 mol
Thí nghiệm 2 chỉ có Al phản ứng (kim loại lưỡng tính):
Al + OH- + H2O \(\rightarrow\) AlO2- + 3/2H2 (2)
0,7/3 0,35 mol
Thí nghiệm 3 cả 3 chất đều phản ứng:
2Na + H2SO4 \(\rightarrow\) Na2SO4 + H2 (3)
Mg + H2SO4 \(\rightarrow\) MgSO4 + H2 (4)
2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2 (5)
Gọi x, y, z tương ứng là số mol của Na, Mg và Al trong a gam hh.
Ta có: x = 0,4 mol; z = 0,7/3 mol; x/2 + y + 3z/2 = 0,5. Suy ra: y = -0.5 < 0 (vô lí)
Bạn xem lại đề bài, đề bài ko đúng.

Đáp án A
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư ⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2) ⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam

Đáp án A
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư
⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2)
⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam

Đáp án A
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư ⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2) ⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam

Đáp án A
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư ⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2) ⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam

Đáp án B
Phần chất rắn chưa tan là Al còn dư
Gọi n K = x mol
Cho hỗn hợp X vào nước, K phản ứng hết tạo KOH và Al phản ứng với KOH và còn dư => tính số mol theo KOH
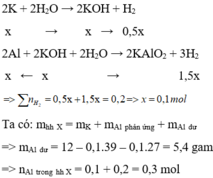
Cho hỗn hợp X tác dụng với dung dịch KOH dư => K phản ứng hết với H 2 O và Al phản ứng hết với KOH
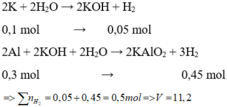

Gọi nAl = x mol ; nSn = y mol → 27x + 119y = 14,6 (1) ; nH2 = 0,25 mol
- Khi X tác dụng với dung dịch HCl:
quá trình oxi hóa:
Al -> Al3 + +3e
x -> 3x
Sn -> Sn2+ +2e
y -> 2y
Qúa trình khử
2H+ + 2e -> H2
0,5<- 0,25
=> 3x+2y=0,5 (2)
(1)(2) => x=y=0,1mol
- Khi X tác dụng O2
quá trình oxi hóa
Al -> Al3 + +3e
x -> 3x
Sn -> Sn4+ +4e
y -> 4y
Qúa trình khử
O2 + 4e -> 2O2-
VO2 = ((3x +4y)/4).22,4 = ((3.0,1+4.0,1)/4).22,4 = 3,92l => D
Đáp án B
m H 2 S O 4 = 19 , 6 g ; m H 2 O = 54 g
Vì Na và Mg dư nên H2SO4,H2O đều hết → V =(0,2 + 1,5). 22,4 = 38,08 lít
câu này hay quên H2O