Cho một hỗn hợp gồm 0,56 gam Fe và 0,64 gam Cu vào 100 ml dung dịch AgNO3 0,45M. Khi kết thúc phản ứng thu được dung dịch. A. Nồng độ mol/lit của dung dịch Fe(NO3)2 trong A là:
A. 0,04
B. 0,05
C. 0,055
D. 0,045.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B.
![]()
n A g N O 3 = 0 , 045 m o l
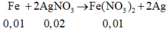
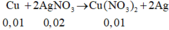

⇒ C M F e N O 3 2 = 0 , 005 0 , 1 = 0 , 05 M

Chất rắn Y chứa 3 kim loại là Ag, Cu, Fe dư.
Y + HCl → 0,035 mol H2 nên n(Fe trong Y) = 0,035 mol
→ n(Fe phản ứng) = 0,05 – 0,035 = 0,015 mol
Đặt n(AgNO3) = x ; n(Cu(NO3)2) = x
Áp dụng ĐLBT mol e : n(AgNO3) + 2n(Cu(NO3)2) = n(Al) + n(Fe phản ứng)
→ x = 0,04 mol
→ CM(AgNO3) = CM(Cu(NO3)2) = 0,4M → Đáp án B

Fedư => AgNO3,Cu(NO3)2 và Al phản ứng hết, phản ứng
Bảo toàn electron ta có: ne cho= nenhận
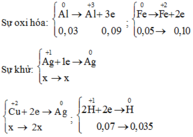
Bảo toàn electron ta có: ne cho= nenhận
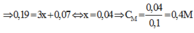

Đáp án B
Cho Y chứa 3 kim loại, tác dụng
với dung dịch HCl dư thu được
0,035 mol khí H2 → Y chứa Fe dư
Vậy Y chứa Cu: x mol ,
Ag: x mol và Fe dư: 0,035 mol
⇒ Fe pư: 0,05 - 0,035 = 0,015 mol
Bảo toàn electron
2nCu(NO3)2 + nAgNO3 = 2nFe + 3nAl
⇒ 2x + x = 2. 0,015 + 0,03. 3
→ x = 0,04 mol
⇒ CMCu(NO3)2 = CMAgNO3
= 0,04 : 0,1 = 0,4M

Cho Y chứa 3 kim loại, tác dụng với dung dịch HCl dư thu được 0,035 mol khí H2 → Y chứa Fe dư
Vậy Y chứa Cu : x mol , Ag: x mol và Fe dư : 0,035 mol
⇒ Fe pư : 0,05 - 0,035 = 0,015 mol
Bảo toàn electron → 2nCu(NO3)2 + nAgNO3 = 2nFe + 3nAl
⇒ 2x + x = 2. 0,015 + 0,03. 3 → x = 0,04 mol
⇒ CMCu(NO3)2 = CMAgNO3 = 0,04 : 0,1 = 0,4M
Đáp án B

Chọn B
Y gồm 3 kim loại: Ag, Cu, Fe dư.
Khi cho Y + HCl ⇒ nFe dư = nH2 = 0,035 ⇒ nFe phản ứng = 0,05 – 0,035 = 0,015
Đặt [Ag+] = [Cu2+] = x
Bảo toàn ne ⇒ nAg+ + 2nCu2+ = 2nFe phản ứng + 3nAl
⇒ 0,1x + 0,1.2x = 2.0,015 + 3.0,03 ⇒ x = 0,4

Đáp án A
Gọi x = nN2, y = nNO2
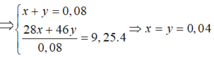
Bảo toàn nguyên tố N => nHNO3 = nNO3- tạo muối + 2nN2 + nNO2
nHNO3 = (10nN2 + nNO2) + 2nN2 + nNO2 = 0,56=> CM của HNO3 = 0,56/2 = 0,28M
Đáp án B