Cho 16,8 gam Fe tác dụng với dung dịch H2SO4 đặc, nóng, thể tích khí SO2 thoát ra ở đktc là:
A.6,72 lít
B. 10,08 lít
C. 2,24 lít
D. 3,36 lít
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Xét giai đoạn m gam Fe tác dụng với dung dịch H2SO4 loãng:
Sơ đồ phản ứng :
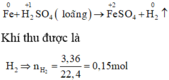
Các quá trình nhường, nhận electron :
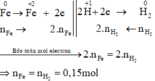
Xét giai đoạn m gam Fe tác dụng với H2SO4 đặc, nóng , dư:
Sơ đồ phản ứng:
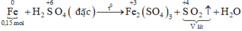
Các quá trình nhường, nhận electron:
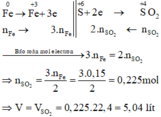

\(\text{Mỗi phần,gọi :} n_{Al} = a ; n_{Fe} = b ; n_{Cu} = c\\ \Rightarrow 27a + 56b + 64c = \dfrac{35,8}{2} = 17,9(1)\\ \text{Phần 1 : Al,Fe không phản ứng với axit đặc nguội}\\ Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O\\ n_{Cu} = c = n_{SO_2} = \dfrac{3,36}{22,4} = 0,15(2)\\ \text{Phần 2 : Cu không phản ứng với axit loãng}\\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{H_2} = 1,5a + b = \dfrac{5,6}{22,4} = 0,25(3)\\ (1)(2)(3) \Rightarrow a = b = 0,1 ; c = 0,15\)
Suy ra :
\(m_{Al} = 0,1.2.27 = 5,4(gam)\\ m_{Fe} = 0,1.2.56 = 11,2(gam)\\ m_{Cu} = 0,15.64.2 = 19,2(gam)\)

\(n_{Fe}=a\left(mol\right),n_{FeO}=b\left(mol\right)\)
\(m_X=56a+72b=12.8\left(g\right)\)
\(n_{H_2}=n_{Fe}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(\Rightarrow a=0.1\)
\(b=\dfrac{12.8-56\cdot0.1}{72}=0.1\left(mol\right)\)
\(BTe:\)
\(3n_{Fe}+n_{FeO}=2n_{SO_2}\)
\(\Rightarrow n_{SO_2}=\dfrac{3\cdot0.1+0.1}{2}=0.2\left(mol\right)\)
\(V_{SO_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(\)

Chọn C
Phần 1 chỉ có Fe phản ứng → nFe = nH2 = 0,1
Phần 2 có cả Fe và Cu phản ứng, mà H2SO4 đặc dư → Fe lên Fe3+ hết
BTE → 3nFe + 2nCu = 2x 0,4 → nCu = (0,8 – 0,3)/2 = 0,25
Vậy 0,5m = 0,1 x 56 + 0,25 x 64 = 21,6 → m = 43,2.

Đáp án : C
P1 : nH2 = nFe = 0,1 mol
P2 : Gọi số mol của Fe và Cu trong P2 lần lượt là x và y
=> bảo toàn e : 3x + 2y = 2nSO2 = 0,8 mol
, mmuối = mCuSO4 + mFe2(SO4)3 = 200x + 160y = 56g
=> x = 0,2 ; y = 0,1 mol
Tỉ lệ mol Fe : Cu trong các phần không đổi
=>Trong P1 : nCu = 0,05 mol
Trong m gam X có: 0,3 mol Fe và 0,15 mol Cu
=> m = 26,4g

Đáp án C
Trong 15,2 gam hỗn hợp kim loại
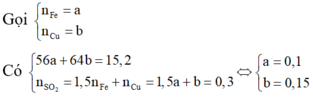
Do đó trong 1,52 gam hỗn hợp kim loại có 0,01 mol Fe.
Khi hòa tan 1,52 gam hỗn hợp kim loại vào dung dịch H2SO4 loãng dư thì nH = nF = 0,01
⇒ V H 2 = 0 , 224 ( lít )

2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
\(n_{SO_2}=\dfrac{3}{2}n_{Fe}=0,15\left(mol\right)\)
=> VSO2=0,15.22,4=3,36(lit)
=> Chọn C
Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Pt : Fe + 2H2SO4 → FeSO4 + SO2 + 2H2O\(|\)
1 2 1 1 2
0,1 0,1
Số mol của khí lưu huỳnh đioxit
nSO2 = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Thể tích của khí lưu huỳnh ddioxxit ở dktc
VSO2 = nSO2 . 22,4
= 0,1. 22,4
= 2,24 (l)
⇒ Chọn câu : A
Chúc bạn học tốt

\(2FeO+4H_2SO_4 \buildrel{{t^o}}\over\longrightarrow Fe_2(SO_4)_3+SO_2+4H_2O\\ n_{Fe}=\frac{10,8}{72}=0,15(mol)\\ n_{SO_2}=\frac{1}{2}.n_{FeO}=\frac{1}{2}.0,15=0,075(mol)\\ V_{SO_2}=0,075.22,4=1,68(l)\)
Cho 10,8 gam sắt (II) oxit tác dụng hoàn toàn với dung dịch H2SO4 đặc nóng tạo thành một khí duy nhất là khí SO2. Tính thể tích khí thu được ở điều kiện tiêu chuẩn?
A. 2,24 lít.
B. 3,36 lít.
C. 4,48 lít.
D. 5,6 lít.
2FeO + 4H2SO4 → 4H2O + Fe2(SO4)3 + SO2
\(n_{SO_2}=\dfrac{1}{2}n_{FeO}=0,075\left(mol\right)\)
=> VSO2= 0,075 .22,4= 1,68 (lít)
Đáp án B