Ngâm một lá kẽm trong 100 ml dung dịch AgNO3 0,2M. Khi phản ứng kết thúc, khối lượng lá kẽm tăng thêm
A. 0,65 gam.
B. 0,86 gam.
C. 1,51 gam.
D. 2,16 gam.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

mAgNO3=5,1g
=> nAgNO3=0,03mol
PTHH: Zn+ 2AgNO3=>Zn(NO3)2+2Ag
0,06 <-0,03 ->0,03 ->0,06
mZn đã dùng:m=0,06.65=3,9g

Đáp án A
Khối lượng kẽm tăng lên chính bằng chênh lệch giữa khối lượng kẽm tan ra và kim loại X bám vào
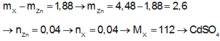

\(\Delta_m=2,28\left(g\right)=m_{Ag}-m_{Cu\text{ p/ứ}}\left(1\right)\\ PTHH:Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\\ \Rightarrow n_{Cu}=\dfrac{1}{2}n_{AgNO_3}\left(2\right)\\ \left(1\right)\left(2\right)\Rightarrow108n_{AgNO_3}-\dfrac{1}{2}n_{AgNO_3}\cdot64=2,28\left(g\right)\\ \Rightarrow n_{AgNO_3}=0,03\left(mol\right)\\ m_{dd_{AgNO_3}}=1,14\cdot60=68,4\left(g\right)\\ n_{Cu}=n_{CuNO_3}=0,015\left(mol\right)\\ \Rightarrow\left\{{}\begin{matrix}m_{CT_{CuNO_3}}=0,015\cdot188=2,82\left(g\right)\\m_{Cu}=0015\cdot64=0,96\left(g\right)\end{matrix}\right.\\ n_{Ag}=0,03\left(mol\right)\\ \Rightarrow m_{Ag}=0,03\cdot108=3,24\left(g\right)\)
\(\Rightarrow m_{dd_{CuNO_3}}=0,96+68,4-3,24=66,12\left(g\right)\\ \Rightarrow C\%_{CuNO_3}=\dfrac{2,82}{66,12}\cdot100\%\approx4,26\%\)
Đáp án C
nAgNO3 = 0,1.0,2 = 0,02 mol
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
Mol 0,01 ¬ 0,02 → 0,02
=> mThanh KL tăng = mAg – mZn = 108.0,02 – 65.0,01 = 1,51g