Cho m gam dung dịch H2SO4 nồng độ C% tác dụng hết với một lượng hỗn hợp hai kim loại kali và magie (dùng dư), thấy khối lượng khí hiđro bay ra là 0,05m gam. Giá trị của C là:
A. 19,73%
B. 15,80%
C.17,93%
D. 18,25%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(2Na+H_2SO_4\rightarrow Na_2SO_4+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(nH_2=\dfrac{0,05}{2}=0,025\left(mol\right)\)
=>\(nH_2SO_4=0,025\left(mol\right)\)
=> \(mH_2SO_4=0,025.98=2,45\left(g\right)\)
- muốn tính C% H2SO4 cần thêm dữ kiện .

Đặt a=100 (g)
Theo đề ta có các PTHH:
\(2K+H_2SO_4\xrightarrow[]{}K_2SO_4+H_2\)(1)
\(Mg+H_2SO_4\xrightarrow[]{}MgSO_{4_{ }}+H_2\)(2)
\(2K+2H_2O\xrightarrow[]{}2KOH+H_2\) (3)
(K dùng dư nên cũng tác dụng với H2O)
Theo đề: \(m_{H_2SO_4}=100\times A\%=A\left(g\right)\)
=> \(n_{H_2SO_4}=\dfrac{A}{98}\left(mol\right)\)
\(n_{H_2}=\dfrac{0,05\times100}{2}=2,5\left(mol\right)\)
\(m_{H_2O}=m_{ddH_2SO_4}-m_{H_2SO_4}=100-A\left(g\right)\)
=>\(n_{H_2O}=\dfrac{100-A}{18}\left(mol\right)\)
Theo PTHH(1),(2),(3) ta có:
\(n_{H_2}=n_{H_2SO_4}+\dfrac{1}{2}\times n_{H_2O}=\dfrac{A}{98}+\dfrac{1}{2}\times\dfrac{100-A}{18}=\dfrac{A}{98}+\dfrac{100-A}{36}=2,5\left(mol\right)\)
=> A=15,8
Vậy nồng độ dung dịch H2SO4 là 15,8%
\(PTHH:\)
\(H_2SO_4+2K--->K_2SO_4+H_2\) \((1)\)
\(H_2SO_4+Mg--->MgSO_4+H_2\) \((2)\)
\(mH_2SO_4=\)\(\dfrac{C\%H_2SO_4.mddH_2SO_4}{100}\)\(=\)\(\dfrac{Aa}{100} (g)\)
\(=> nH_2SO_4=\dfrac{Aa}{100}.98=0,98Aa (mol)\)
\(nH_2=\dfrac{0,05a}{2} = 0,025a (mol)\)
Theo PTHH (1) và (2) \(nH_2SO_4=nH_2\)
\(<=> 0,98Aa=0,025a\)
\(<=> 0,98A=0,025\)
\(<=> A=39,2 \)
Vậy nồng độ phần trăm của dung dich \(H_2SO_4\) cần tìm là \(39,2\%\)

\(n_{H_2} = \dfrac{0,05a}{2} = 0,025a(mol)\\ n_{HCl} = \dfrac{a.C\%}{36,5} = \dfrac{a.C}{3650}(mol)\\ n_{H_2O} = \dfrac{a-a.C\%}{18}(mol)\)
\(Na + HCl \to NaCl + \dfrac{1}{2}H_2\\ K + HCl \to KCl + \dfrac{1}{2}H_2\\ Na + H_2O \to NaOH + \dfrac{1}{2}H_2\\ K + H_2O \to KOH + \dfrac{1}{2}H_2\\ 2n_{H_2} = n_{HCl} + n_{H_2O}\\ \Rightarrow 0,025a.2 = \dfrac{a.C}{3650} + \dfrac{a-a.C\%}{18}\)
\(\Leftrightarrow 0,05 = \dfrac{C}{3650} + \dfrac{1-0,01C}{18}\\ \Rightarrow C = 19,72\)

a) Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng:
MO + H2SO4 →MSO4 + H2O (1)
M(OH)2 + H2SO4 →MSO4 + 2H2O (2)
MCO3 + H2SO4 →MSO4 + H2O + CO2 (3)
Nếu tạo muối axít ta có các phản ứng:
MO + 2H2SO4 →M(HSO4)2 + H2O (4)
M(OH)2 + 2H2SO4 →M(HSO4)2 + 2H2O (5)
MCO3 + 2H2SO4 →M(HSO4)2 + H2O + CO2 (6)
Ta có :
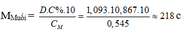
– TH1: Nếu muối là MSO4 M + 96 = 218 M = 122 (loại)
– TH2: Nếu là muối M(HSO4)2 M + 97.2 = 218 M = 24 (Mg)
Vậy xảy ra phản ứng (4, 5, 6) tạo muối Mg(HSO4)2
b) Theo (4, 5, 6) Số mol CO2 = 0,448/22,4 = 0,02 molz = 0,02 (I)
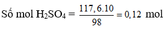
2x + 2y + 2z = 0,12 (II)
Đề bài: 40x + 58y + 84z = 3,64 (III)
Giải hệ (I, II, III): x = 0,02; y = 0,02; z = 0,02
%MgO = 40.0,02.100/3,64 = 21,98%
%Mg(OH)2 = 58.0,02.100/3,64 = 31,87%
%MgCO3 = 84.0,02.100/3,64 = 46,15%

nH2 = 0,13 mol; nSO2 = 0,25 mol
Ta có
2H+ + 2e → H2 Cu → Cu2+ + 2e
0,26 ←0,13 0,12 0,24
S+6 + 2e → S+4
0,5 ← 0,25
TH1: M là kim loại có hóa trị không đổi
=> nCu = (0,5 – 0,26) : 2 = 0,12 mol => mCu = 7,68g
=> mM = 3,12g (loại vì khối lượng của M lớn hơn của Cu)
TH2: M là kim loại có hóa trị thay đổi
Do M không có hóa trị I do đó khi phản ứng với HCl thì M thể hiện hóa trị II
M + 2HCl → MCl2 + H2
0,13 ← 0,13
Do M có hóa trị thay đổi => khi phản ứng với H2SO4 đặc nóng thì M thể hiện hóa trị III
2M + 6H2SO4 → M2(SO4)3 + 3SO2 + 6H2O
0,13 → 0,195
Cu + 2H2SO4 → CuSO4+ SO2 + 2H2O
0,055 ← 0,055
=> mM = 10,8 – 0,055 . 64 = 7,28g
=> MM = 56 => Fe
Ta có số mol của Cu và Fe trong 10,8 g lần lượt là 0,055 và 0,13 mol
=> Trong 5,4g có số mol Cu và Fe lần lượt là 0,0275 và 0,065 mol
nAgNO3 = 0,16mol
Fe + 2AgNO3 → Fe(NO3)2 +2Ag
0,065 0,13 0,065 0,13
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,015 0,03 0,03
=> nCu dư = 0,0275 – 0,015 = 0,0125mol
m = mCu dư + mAg = 0,0125 . 64 + 0,16 . 108 = 18,08g

a) B là \(Al_2\left(SO_4\right)_3\), C là \(Cu\)
\(b)n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,3 0,1 0,3
\(m_{hh}=0,2.27+3,2=8,6g\\ \%m_{Cu}=\dfrac{3,2}{8,6}\cdot100=37,21\%\\ \%m_{Al}=100-37,21=62,79\%\\ c)C_{M_{H_2SO_4}}=\dfrac{0,3}{0,25}=1,2M\)

Gọi nMg=a mol nAl=b mol
=>mcr=24a+27b=6,3 gam
Mg+2HCl=>MgCl2+H2
a mol =>a mol
2Al+6HCl=>2AlCl3+3H2
b mol =>1,5b mol
nH2=1,5b+a=0,3
=>b=0,1 mol a=0,15 mol
mMg=3,6 gam
mAl=2,7gam
Gọi CT oxit là M2On
nH2 + M2On => 2M + nH2O
0,3 mol=>0,3/n mol
n oxit=0,3/n mol
=>m oxit=0,3(2M+16n)=17,4n
=>M=21n
chọn n=8/3
=>M=56 CT oxit của M là Fe3O4
Đáp án B
Chọn m = 100 (gam). Vì kim loại dùng dư nên sau khi axit hết, K tác dụng với nước cũng sinh H2.