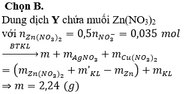Hỗn hợp X gồm ba kim loại Al, Fe, Cu. Cho m gam hỗn hợp X vào dung dịch CuSO4 (dư) sau khi phản ứng xảy ra hoàn toàn thu được 35,2 gam kim loại. Nếu cũng hòa tan m gam hỗn hợp X vào 500 ml dung dịch HCl 2M đến khi phản ứng xảy ra hoàn toàn thu được 8,96 lít khí H2 (đktc), dung dịch Y và a gam chất rắn.Viết phương trình phản ứng xảy ra và tìm giá trị của a.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

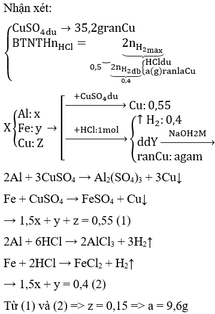

Bắt đầu xuất hiện kết tủa nghĩa là: NaOH đầu tiên sẽ trung hòa HCl dư trước
NaOH + HCldư → NaCl + H2O
0,2 ←0,2
→ 2V1 = 0,2 → V1 = 0,1
Đến khi kết tủa không thay đổi khối lượng thì khi đó kết tủa bị hòa tan hết.
3NaOH + AlCl3 → 3NaCl + Al(OH)3↓
3x ←x → x
NaOH + Al(OH)3 → NaAlO2 + 2H2O
x ←x
→ 0,2 + 4x = 0,6.2 → x = 0,25
=> y = 0,025
=> m = 17,75g

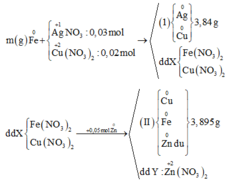
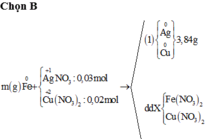
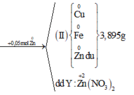
Từ sơ đồ phản ứng ta thấy Fe từ số oxi hóa 0 vẫn về 0
=> ne( Ag+, Cu2+ nhận) = ne ( Zn nhường)
Mà ∑ ne ( Ag+, Cu2+ nhận) = 0,03.1 + 0,02.2 = 0,07 < ne ( Zn nhường) = 0,1 (mol)
=> Zn còn dư sau phản ứng
=> nZn pư = ½ ne nhận = ½. 0,07 = 0,035 (mol)
=> nZn dư = 0,05 – 0,035 = 0,015 (mol)
mFe + mAg bđ + mCu bđ + mZn dư = mAg+Cu (I) + mCu + Fe + Zn (II)
=> mFe = mAg+Cu (I) + mCu + Fe + Zn (II) - ( mAg bđ + mCu bđ + mZn dư )
=> mFe = 3.84 + 3,895 – (0,03.108 + 0,02.64 + 0,015. 65)
mFe = 2,24 (g)
Đáp án B

Chọn đáp án B
Có 0,2.(0,15 + 0,1.2) = 0,07 mol nitrat trong suốt quá trình phản ứng, và như thế theo tiêu chí kim loại càng mạnh càng sót lại trước tiên thì dung dịch Y chỉ còn ion của kẽm khi lượng được đưa vào X lên tới 3,25/65 = 0,05 mol nên có 0,035 mol Zn2+ trong Y.
Bảo toàn khối lượng phần kim loại
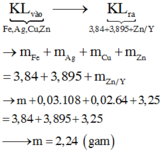

Đáp án A
![]()
→ cuối cùng Y cho 0,035 mol Z n ( N O 3 ) 2
Bảo toàn khối lượng lần 1:
![]() = 7,26 gam
= 7,26 gam
Bảo toàn khối lượng lần 2:
![]()
= 2,240 gam

Đáp án A
![]()
↔ 0,05 mol => cuối cùng Y cho 0,035 mol Z n ( N O 3 ) 2
Bảo toàn khối lượng lần 1: ![]() = 7,26 gam
= 7,26 gam
Bảo toàn khối lượng lần 2: => m = 7,26 + 3,84 - 0,03.170 - 0,02.188 = 2,240 gam