Cho m gam hỗn hợp gồm Al4C3 và CaC2 tác dụng với nước dư, thu được 11,2 lít (đktc) hỗn hợp khí gồm CH4 và C2H2. Chia X thành 2 phần:
- Phần 1: cho tác dụng với dung dịch brom dư thấy có 16 gam Br2 tham gia phản ứng.
- Phần 2: đốt cháy hoàn toàn rồi cho toàn bộ sản phẩm cháy hấp thụ hết vào bình đựng dung dịch Ba(OH)2 dư, sau phản ứng lọc bỏ kết tủa thấy khối lượng dung dịch trong bình giảm 69,525 gam so với khối lượng dung dịch trước phản ứng.
a) Tìm giá trị của m và tính thành phần phần trăm theo thể tích của các khí trong X.
b) Nếu cho phần 2 tác dụng với lượng dư dung dịch AgNO3 trong NH3 thì thu được a gam kết tủa. Tìm giá trị của a.

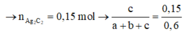

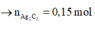
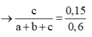

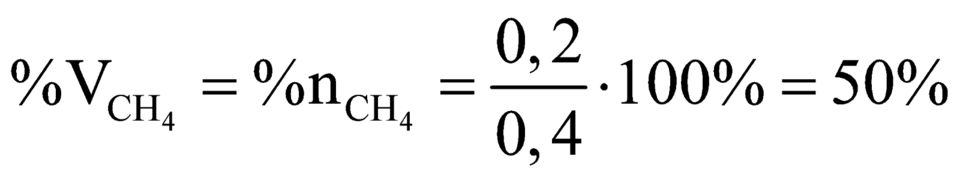
- Phần 1 tác dụng với Br2: nBr2 = 16:160 = 0,1 mol
C2H2 + 2Br2 → C2H2Br4
0,05 ← 0,1 (mol)
- Đặt số mol khí mỗi phần như sau:
+ Số mol hỗn hợp khí X là: nX = 11,2:22,4 = 0,5 mol
Ta có: n khí P1 + n khí P2 = nX => 0,05 + x + 0,05k + kx = 0,5 <=> (x + 0,05)k = 0,45 - x
=>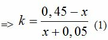
+ Đốt cháy phần 2:
C2H2 + 2,5O2 → t ∘ 2CO2 + H2O
0,05k → 0,1k→ 0,05k (mol)
CH4 + 2O2 → t ∘ CO2 + 2H2O
kx → kx → 2kx (mol)
Sản phẩm cháy gồm
dẫn qua dung dịch Ba(OH)2 dư:
CO2 + Ba(OH)2 → BaCO3↓ + H2O
k(x+0,1) → k(x+0,1) (mol)
Khối lượng dung dịch giảm: m dd giảm = mBaCO3 – mCO2 – mH2O
=> 197k(x+0,1) – 44k(x+0,1) – 18k(2x+0,05) = 69,525
=> 153k(x+0,1) – 18k(2x+0,05) = 69,525
=> k(117x+14,4) = 69,525
CaC2 + 2H2O → Ca(OH)2 + C2H2
0,2 ← 0,2 (mol)
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
0,1 ← 0,1 (mol)
Giá trị của m là: m = mCaC2 + mAl4C3 = 0,2.64 + 0,1.144 = 27,2 gam
Phần trăm thể tích các khí trong X là:
tác dụng với AgNO3 trong NH3 dư:
C2H2 + 2AgNO3 + 2NH3 → Ag2C2↓ + 2NH4NO3
0,15 → 0,15 (mol)
Khối lượng kết tủa thu được là: mAg2C2 = 0,15.240 = 36 gam